Items, objectifs pédagogiques
Item 47 – Dépistage des anomalies orthopédiques, des troubles visuels, auditifs et dentaires
- Argumenter les modalités de dépistage et de prévention des troubles de la vue et de l’ouïe.
- Argumenter les modalités de dépistage et de prévention des troubles du développement bucco-dentaire.
- Argumenter les modalités de dépistage et de prévention des principales anomalies orthopédiques.
- Connaître les modalités du dépistage de la luxation congénitale de la hanche au cours des six premiers mois.
- Connaître la morphologie des membres inférieurs de l’enfant et son évolution au cours de la croissance.
- Connaître les déformations du rachis de l’enfant et de l’adolescent, les modalités de leur dépistage, et leurs conséquences.
Item 52 – Strabisme et amblyopie de l’enfant
Savoir dépister un strabisme et/ou une amblyopie de l’enfant
Item 89 – Altération de la fonction auditive
- Connaître les grands types de surdité.
- Connaître les principales hypothèses diagnostiques, les examens complémentaires pertinents et les principes de traitement.
- Particularités chez l’enfant et chez le sujet âgé.
Avant de commencer…
Les dépistages des troubles sensoriels et des principales anomalies orthopédiques font partie des 5 axes de suivi de l’enfant âgé de 0 à 6 ans. Ils s’inscrivent dans le contenu des examens médicaux réguliers.
Les déficits sensoriels (visuels et auditifs) constituent un handicap relationnel pour l’enfant. Ils sont à haut risque de perturber son développement mental et sa capacité de socialisation.
Le médecin traitant de l’enfant a pour missions :
- d’identifier les facteurs de risque ;
- de repérer les signes d’appel (signalés par la famille ou l’entourage) ;
- d’examiner l’enfant et de pratiquer des tests simples de dépistage ;
- d’orienter éventuellement vers un spécialiste si nécessaire.
Un dépistage précoce est essentiel pour espérer le pronostic le plus optimal.
I. Dépistage des troubles visuels
A. Pour bien comprendre
1. Généralités
Le dépistage des troubles visuels de l’enfant est un enjeu de santé publique.
Près de 20 % des enfants âgés de moins de 6 ans présentent une anomalie visuelle, le plus sou-vent une anomalie de réfraction (hypermétropie, myopie, astigmatisme) responsable de difficultés scolaires.
Un dépistage systématique permet une prise en charge précoce et constitue le garant d’un pronostic visuel optimal. Ce dépistage peut être réalisé de façon optimale par le pédiatre, l’ophtalmologiste ou l’orthoptiste. Des repères sont inscrits dans le carnet de santé.
L’amblyopie (baisse de vision unilatérale), qui concerne 2 à 5 % des enfants, doit être dépistée tôt pour être rééduquée sachant qu’après 6 ans la récupération visuelle est très limitée voire impossible.
2. Évolution normale de la fonction visuelle
Le système visuel est immature à la naissance et son développement anatomique et fonctionnel se poursuit jusqu’à l’âge de 10 ans.
Toute perturbation dans l’évolution de la fonction visuelle peut entraîner une amblyopie.
Les grandes étapes de maturation du système visuel sont :
- à la naissance : fixation d’un visage à faible distance, clignement à la lumière vive, acuité vi-suelle évaluée en moyenne à 1/20e ;
- entre les âges de 2 et 4 mois : mouvements de poursuite oculaire (3 mois au plus tard), réflexe de clignement à la menace, convergence normale, début de vision des couleurs et de vision stéréoscopique, acuité visuelle à 1/10e ;
- à partir de l’âge de 12 mois : 1 an : acuité visuelle à 4/10e, 2 ans : acuité visuelle à 6/10e, 4 ans : acuité visuelle à 10/10e.
L’acuité visuelle est la faculté de distinguer des détails fins, soit deux points distincts, et éloignés d’une certaine distance. Elle se mesure de 1 à 10/10e en vision de loin, et de P14 à P2 en vision de près. Une acuité visuelle de 10/10e P2 correspond à une vision normale.
Elle ne suffit pas à assurer une bonne qualité de vision. D’autres éléments entrent en jeu dans la performance visuelle : champ visuel, sensibilité au contraste, vision des couleurs, vision stéréoscopique.
Système visuel immature à la naissance (acuité visuelle à 1/20e).
Enjeux du dépistage : éviter le handicap visuel.
B. Dépister : qui ?
1. Généralités
Tous les enfants requièrent un dépistage répété des troubles visuels, sachant qu’un enfant sur cinq âgé de moins de 6 ans présente une anomalie visuelle.
Un bilan visuel systématique est proposé : à la naissance, au 2e, 4e, 9e et 24e mois de vie (période préverbale).
Au cours de la 3e–4e et de la 6e année de vie, un examen de santé avec dépistage visuel est effectué à l’école par la PMI ou la médecine scolaire.
Le médecin ou un orthoptiste doit identifier les facteurs de risque et les signes d’appel des troubles visuels.
Un examen de l’enfant et la pratique de tests simples de dépistage sont nécessaires pour détecter une anomalie susceptible d’être corrigée par une prise en charge spécifique et précoce.
2. Facteurs de risque
La mise en évidence d’un ou plusieurs de ces facteurs de risque doit rendre très attentif dès la naissance (tableau 4.1).
Elle conduit systématiquement à réaliser un examen ophtalmologique avec réfraction après cycloplégie entre les âges de 3 et 12 mois, même en l’absence de signes d’appel.
Tableau 4.1. ![]() Facteurs de risque de troubles visuels (SFP).
Facteurs de risque de troubles visuels (SFP).
| Antécédents personnels |
|
| Antécédents familiaux |
|
Facteurs de risque à retenir : antécédents familiaux, prématurité, embryofœtopathies.
3. Signes d’appel
Ces signes d’appel sont à rechercher par l’anamnèse, ou rapportés par les parents (tableau 4.2).
Ils imposent dès leur mise en évidence une consultation rapide avec un ophtalmologiste.
Tableau 4.2. ![]() Signes d’appel de troubles visuels.
Signes d’appel de troubles visuels.
| Âge | Signes d’appel | Suspecter |
| Avant 4 mois |
|
|
| De 6 mois à l’âge verbal |
|
|
| Entre 2 et 5 ans |
|
|
| Chez l’enfant plus âgé |
|
Signes d’alerte à retenir : absence de poursuite oculaire, retard psychomoteur, troubles des apprentis-sages.
C. Dépister : comment et quoi ?
1. Examens de dépistage
Principes et définitions
Le médecin traitant doit pouvoir réaliser un examen clinique et des tests de base.
De bonnes conditions d’examen sont indispensables : enfant calme n’ayant ni faim ni sommeil, lumière douce non éblouissante.
En cas d’anomalies ou d’incertitude, l’enfant doit être adressé au médecin spécialiste.
La leucocorie est un reflet blanc dans la pupille pouvant être observé par les parents (photo avec flash par exemple). Elle doit faire rechercher un rétinoblastome, une cataracte congénitale (fig. 4.1). La mégalocornée ou buphtalmie (augmentation de taille du globe oculaire, fig. 4.2) doit faire rechercher un glaucome congénital. Une prise en charge urgente est nécessaire.
Le nystagmus se traduit par des mouvements saccadés des yeux le plus souvent horizontaux. Il peut être congénital ou acquis.
Le signe de la toupie s’applique à un enfant dont l’œil amblyope ne permet pas de regarder un objet placé du même côté que l’œil atteint. L’enfant tourne alors la tête afin de continuer à re-garder l’objet avec l’œil sain controlatéral.
Le test de Lang teste la vision stéréoscopique.

Fig. 4.1. ![]() Cataracte de l’œil droit avec leucocorie.
Cataracte de l’œil droit avec leucocorie.

Fig. 4.2. ![]() Buphtalmie avec mégalocornée et larmoiement de l’œil gauche.
Buphtalmie avec mégalocornée et larmoiement de l’œil gauche.
Source : Dominique Brémond-Gignac.
Bilans visuels
À tout âge :
- examen des paupières : ptosis, épicanthus, angiome ;
- examen des globes oculaires : microphtalmie, buphtalmie (glaucome congénital) ;
- examen des conjonctives : rougeur, larmoiement (obstruction du canal lacrymal) ;
- examen des cornées : opacité cornéenne (anomalie de Peters), mégalocornée (glaucome congénital) ;
- examen des pupilles : leucocorie (rétinoblastome, cataracte), anisocorie (neuroblastome).
Au cours des premières semaines de vie :
- réflexe photomoteur (réflexe présent dès la naissance si enfant non prématuré) ; recherche de l’absence de clignement à la lumière (réflexe présent dès les premières semaines de vie) ;
- lueur pupillaire (red reflex) : recherche d’un trouble des milieux transparents ;
- reflets cornéens : recherche d’un strabisme ;
- poursuite oculaire horizontale (cible noir et blanc) : acquisition au plus tard à 2 ou 3 mois de vie.
À l’âge de 4 mois :
- fixation monoculaire et binoculaire : recherche d’une absence de réflexe de fixation ;
- poursuite oculaire : recherche de nystagmus, amblyopie.
Entre les âges de 9 et 15 mois :
- occlusion alternée : recherche d’une amblyopie ;
- signe de la toupie : recherche d’une anomalie de la motilité oculaire, d’une amblyopie ;
- tests stéréoscopiques (test de Lang) : recherche d’une amblyopie.
Entre les âges de 2 ans ½ et 4 ans : mesure de l’acuité visuelle (tests de Pigassou, du Cadet) : re-cherche d’une anomalie de la réfraction.
À partir de l’âge de 5 ans :
- mesure de l’acuité visuelle (tests de chiffres et de lettres : tests du Cadet, fig. 4.3 ; échelle de Monoyer) ;
- examen de la vision des couleurs (test d’Ishihara) : recherche d’une dyschromatopsie.

Fig. 4.3. ![]() Tests du CADET. Test Vision de loin « Images ».
Tests du CADET. Test Vision de loin « Images ».
Source : CADET, Cercle d’Action pour le Dépistage, l’Exploration et le Traitement des troubles visuels, cadet-association.fr.
Urgence : leucocorie, cornée trouble, mégalocornée, strabisme constant, nystagmus.
2. Points clés à propos de certaines causes
Strabisme
Le strabisme est une anomalie de la vision binoculaire caractérisée par la déviation des axes visuels (fig. 4.4).
Un strabisme intermittent et alternant peut traduire, jusqu’à l’âge de 3 mois, un simple re-tard de l’acquisition de l’oculomotricité avec spasmes accommodatifs.
Un strabisme permanent ou divergent quel que soit l’âge de l’enfant, ou un strabisme décelé après l’âge de 3 mois, doit être considéré comme pathologique. Il s’agit alors le plus souvent d’un strabisme accommodatif, lié à une hypermétropie latente. Il peut être lié plus rarement à une cause organique (rétinoblastome, cataracte congénitale).
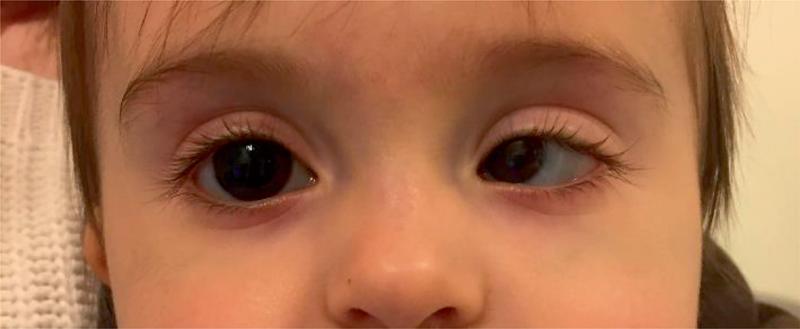
Fig. 4.4. ![]() Strabisme convergent gauche.
Strabisme convergent gauche.
Source : Dominique Brémond-Gignac.
Le diagnostic positif de strabisme peut être fait par :
- étude des reflets cornéens : reflet dévié pour l’œil strabique ;
- test à l’écran unilatéral alterné : mouvement de refixation de l’œil strabique.
Un examen ophtalmologique spécialisé permet de rechercher une cause :
- étude de la réfraction sous cycloplégie : hypermétropie latente, myopie ;
- examen du segment antérieur (lampe à fente) : cataracte ;
- examen du segment postérieur (fond d’œil) : rétinoblastome.
La complication à craindre est l’amblyopie fonctionnelle de l’œil strabique.
Strabisme permanent ou divergent, strabisme intermittent mais persistant après l’âge de 3 mois = pathologique.
Éliminer une cause organique : rétinoblastome ou cataracte.
Rechercher une amblyopie fonctionnelle de l’œil strabique.
Amblyopie
L’amblyopie traduit une mauvaise acuité visuelle par non-usage d’un œil, susceptible d’entraîner un trouble irréversible de la maturation du cortex visuel.
Sa cause est le plus souvent fonctionnelle (secondaire à un trouble de la réfraction ou à un strabisme), parfois organique.
Le diagnostic positif d’amblyopie peut être fait par :
- test à l’écran alterné :
- réaction de défense à l’occlusion de l’œil sain : amblyopie ;
- maintien impossible de la fixation par l’œil strabique : amblyopie ;
- manœuvres droite/gauche avec lunettes à écran nasal :
- si changement d’œil fixateur : pas d’amblyopie ;
- si pas de changement : amblyopie du côté de l’œil ne pouvant suivre l’objet.
Un examen ophtalmologique spécialisé permet de rechercher une cause :
- anomalie de la réfraction, strabisme ;
- affection organique sous-jacente (rétinoblastome, cataracte).
Une rééducation précoce (avant l’âge de 6 ans) permet souvent une récupération visuelle optimale des amblyopies fonctionnelles.
Amétropie
L’amétropie est une anomalie de la réfraction de l’œil :
- myopie ;
- hypermétropie (souvent physiologique chez le jeune enfant) ;
- astigmatisme.
Ces troubles sont fréquents (avec une augmentation majeure de la fréquence de la myopie de l’enfant) et entraînent une baisse d’acuité visuelle dont les signes d’appel à rechercher sont : rougeur, picotements oculaires, clignements, lecture trop rapprochée, céphalées.
Sauf si l’acuité visuelle mesurée est à 10/10e de chaque œil, les tests d’acuité visuelle ne sont interprétables de façon fiable qu’après l’âge de 4 ans. Une acuité visuelle < 7/10e entre les âges de 3 et 4 ans ou une différence d’acuité visuelle ≥ 2/10e entre les deux yeux sont à considérer comme anormales.
II. Dépistage des troubles auditifs
A. Pour bien comprendre
1. Généralités
Le dépistage des troubles auditifs de l’enfant est un enjeu de santé publique.
Environ 5 % des enfants âgés de moins de 6 ans ont une anomalie auditive.
Le dépistage des surdités permet une prise en charge adaptée susceptible de réduire les troubles du langage, les pathologies psychoaffectives, et de ne pas entraver l’insertion sociale future. Ce dépistage est proposé à tous les nouveau-nés en maternité et se poursuit les premières années de vie de l’enfant.
2. Classification des surdités de l’enfant
L’oreille interne est mature avant la naissance.
Le son est caractérisé par sa fréquence (son grave/aigu), exprimée en hertz (Hz) et par son intensité mesurée en décibels (dB). Pour repère : chuchotement = 35 dB, conversation tranquille = 60 dB, aspirateur = 70 dB, moto = 90 dB, discothèque = 110 dB.
Les principaux types de surdité chez l’enfant sont :
- les surdités de perception :
- dues à une atteinte de l’oreille interne, du nerf auditif ou des centres auditifs ;
- surtout congénitales d’origine génétique ;
- parfois acquises (pathologies périnatales, infection, traumatisme, ototoxique) ;
- les surdités de transmission :
- dues à une atteinte de l’oreille externe ou moyenne ;
- surtout acquises (otite séreuse, otite chronique, traumatique) ;
- exceptionnellement congénitales (malformation de l’oreille externe ou moyenne) ;
- les surdités mixtes avec à la fois une surdité de perception et une surdité de transmission sur la même oreille : association de pathologies, surdités syndromiques.
La perte audiométrique moyenne (PAM) sur les fréquences 500, 1 000, 2 000 et 4 000 Hz (utiles pour la compréhension de la parole dites fréquences conversationnelles) permet de classer les surdités à plusieurs niveaux : légère = PAM entre 21 et 40 dB ; moyenne = PAM entre 41 et 70 dB ; sévère = PAM entre 71 et 90 dB ; profonde = PAM ≥ 90 dB ; totale (cophose) = PAM ≥ 120 dB.
Les répercussions de la perte auditive sur le développement de la parole et du langage dépendent principalement de la PAM et de l’âge d’apparition de la surdité, car l’audition est indispensable à la mise en place de la boucle audiophonatoire et la construction de l’intersubjectivité chez le nourrisson.
Enjeux du dépistage auditif : pronostic auditif, développement de la parole et du langage, développe-ment psychoaffectif, insertion sociale.
B. Dépister : qui ?
1. Généralités
Le dépistage des troubles auditifs se fait à différents moments du développement.
Un dépistage auditif est proposé à tous les nouveau-nés en maternité.
Ensuite, à l’occasion des examens pour les certificats des 9e et 24e mois ainsi qu’au 36e mois, un dépistage des réactions auditives du nourrisson et de l’enfant est prévu ; les signes auditifs attendus et les repères sont inscrits dans le carnet de santé. Un dépistage scolaire est souvent pro-posé avant l’entrée au CP.
Le médecin doit savoir repérer les facteurs de risque de surdité et les signes d’appel des troubles auditifs. Un examen de l’enfant et la pratique de tests simples de dépistage sont nécessaires pour détecter une anomalie susceptible de requérir une prise en charge spécifique et précoce.
2. Facteurs de risque
La mise en évidence de facteurs de risque doit conduire à une vigilance prolongée ou à demander un avis spécialisé, même après un dépistage rassurant (tableau 4.3).
Plus de la moitié des enfants qui ont une surdité de perception bilatérale congénitale n’ont aucun facteur de risque, d’où l’intérêt d’un dépistage systématique en maternité.
Tableau 4.3. ![]() Facteurs de risque de troubles auditifs.
Facteurs de risque de troubles auditifs.
| Antécédents familiaux | Antécédents familiaux de surdité, prothèse auditive avant l’âge de 50 ans |
| Antécédents personnels de la période périnatale |
|
| Antécédents personnels après la période néonatale (surdité acquise) |
|
Facteurs de risque de surdité congénitale : antécédents familiaux, grande prématurité, CMV, toxoplasmose et rubéole, malformations cervico-faciales, atteinte neurologique.
Facteurs de risque de surdité acquise : méningite bactérienne, traumatismes craniofaciaux.
3. Signes d’appel
Ces signes d’appel sont à rechercher à l’anamnèse, rapportés par les parents ou l’entourage de l’enfant (tableau 4.4).
L’appareil de l’équilibre est associé à l’appareil auditif. Ces enfants peuvent présenter aussi des retards psychomoteurs en rapport avec une dysfonction vestibulaire. Dans le cas des fœtopathies à CMV, le retard psychomoteur peut être au premier plan, voire isolé ; de même que dans certaines causes génétiques ou syndromiques, la surdité s’associe à des aréflexies vestibulaires bilatérales qui entraînent un retard psychomoteur massif.
Tableau 4.4. ![]() Signes d’appel de troubles auditifs.
Signes d’appel de troubles auditifs.
| Âge | Signes d’appel |
| Dans les premiers mois |
|
| De 6 à 12 mois |
|
| De 12 à 24 mois |
|
| De 24 à 36 mois |
|
| Après 3 ans |
|
| Surdité d’apparition secondaire et acquise |
|
Ces signes imposent dès leur mise en évidence une consultation rapide avec un spécialiste ORL.
Signes d’alerte : pas de réaction aux bruits, retard psychomoteur, retard de langage, troubles importants de l’articulation, pathologie des interactions, difficultés d’apprentissage.
C. Dépister : comment et quoi ?
1. Examens de dépistage
Principes et définitions
En maternité, les outils de dépistage sont les otoémissions acoustiques provoquées (OEAP) et/ou les potentiels évoqués auditifs automatisés (PEAA).
En cas d’examen anormal à deux reprises en maternité, l’enfant doit être adressé à un spécialiste ORL pour un contrôle. Si les tests sont de nouveaux anormaux, l’enfant sera adressé vers un centre d’audiologie pédiatrique pour l’étape diagnostique.
L’audiogramme et les potentiels évoqués auditifs (PEA) réalisés en audiologie pédiatrique sont alors des examens diagnostiques et non de dépistage.
Il faut noter que les OEAP ne repèrent pas toutes les surdités : elles peuvent être présentes (= réponse normale au test de dépistage) et l’enfant réellement sourd (neuropathie auditive), donc passé au travers du dépistage…
Dans la période 1 mois–6 ans, le médecin traitant doit pouvoir réaliser un examen clinique et des tests de base. De bonnes conditions d’examen sont indispensables : enfant calme et disponible, local silencieux.
Les tests de dépistage peuvent être réalisés en audiométrie vocale (utilisation de la voix ; par exemple, appel à différentes intensités, désignation d’images) ou en audiométrie tonale (utilisa-tion d’instruments sonores). Le babymètre délivre un bruit blanc filtré d’intensité variable.
Des réactions comportementales franches chez le nourrisson (mimique de surprise, arrêt de la motricité spontanée) à 70 dB permettent d’éliminer le diagnostic de surdité sévère à profonde bilatérale. L’absence de réponse n’est pas pour autant toujours synonyme de surdité.
Les boîtes à retournement (boîtes de Moatti®) sont des sources sonores calibrées testant des fré-quences aiguës, médium et graves, à une intensité de l’ordre de 60 dB à 1 mètre de distance, et permettent aussi de repérer les troubles auditifs les plus sévères entre 6 et 24 mois.
Pour les enfants plus âgés, il existe des appareils de test auditif rapide utilisables dès 3–4 ans (Au-richeck®) qui permettent de repérer un déficit en oreille séparée.
En cas d’anomalie de l’examen et/ou de trouble auditif observé par les parents, l’enfant doit être adressé à un spécialiste ORL.
Bilans auditifs
À tout âge :
- examen du conduit, du pavillon et de l’anatomie cervico-faciale ;
- otoscopie.
Chez le nouveau-né :
- tests objectifs en maternité : OEAP et/ou PEAA (orienter en milieu spécialisé si anomalies) ;
- tests subjectifs : réflexe cochléopalpébral, babymètre (faux positifs et négatifs).
Entre les âges de 6 mois et 2 ans :
- réflexe d’orientation-investigation : boîtes à retournement, réaction au prénom ;
- OEAP.
Entre les âges de 2 et 4 ans :
- réflexe d’orientation-investigation : réaction au prénom, mots familiers ;
- test à la voix : imagier (animaux ou objets familiers à désigner).
À partir de l’âge de 4 ans :
- audiométrie vocale de dépistage : tests de désignation (mots/images) ;
- audiométrie tonale de dépistage : quantification de seuils auditifs à l’aide d’un casque.
L’étape diagnostique d’une surdité de l’enfant comprend, outre un interrogatoire ciblé, une otoscopie et un examen général de l’enfant, une audiométrie tonale (et vocale quand le niveau de langage de l’enfant le permet), qui doit toujours être confirmée par des épreuves objectives reposant essentiellement sur les PEA avec recherche de seuils auditifs et des ASSR (Auditory Steady State Response).
2. Points clés à propos de causes de surdités
Surdités permanentes
Surdités de perception
Les causes de ces surdités sont le plus souvent génétiques (80 % des cas), de transmission autosomique récessive (donc pas d’antécédent dans la famille), plus rarement de transmission autosomique dominante.
Elles peuvent être isolées (le plus souvent) ou s’intégrer dans un syndrome malformatif.
Plus rarement, le contexte périnatal est évocateur : prématurité, hyperbilirubinémie, asphyxie périnatale, embryofœtopathie…
Les méningites bactériennes (à pneumocoque et méningocoque principalement) peuvent en-traîner des surdités dans les heures, jours ou mois qui suivent l’infection, avec atteinte associée de l’appareil vestibulaire (voir chapitre 37).
La fœtopathie à CMV entraîne des surdités uni- ou bilatérales qui peuvent évoluer rapidement mais également sur le long terme.
Surdités de transmission congénitales
Elles sont toutes malformatives (osselets, conduit auditif externe) et s’intègrent dans des syndromes ou anomalies chromosomiques : trisomie 21, 22q11, anomalie 18q, syndrome otomandibulaire…
Cas particuliers
Otite séromuqueuse (OSM)
C’est la cause la plus fréquente des surdités de transmission entre 1 et 6 ans.
La baisse d’audition est très variable, de 5 à 50 dB.
Attention : en raison de sa fréquence, elle peut masquer un trouble auditif permanent sous-jacent.
L’otoscopie identifie un épanchement rétrotympanique sans infection, donnant au tympan un aspect ambré, mat et parfois rétracté, ou associé à un niveau liquidien ou des bulles rétrotympaniques (voir fig. 32.5 au chapitre 32).
Le tympanogramme, réalisé en raison de la baisse d’audition, est plat (perte de l’allure normale en « toit de pagode ») mais ne prédit pas le seuil auditif.
Une évaluation d’un terrain à risque et la prise en charge des facteurs associés sont nécessaires. En cas de persistance de l’otite séreuse à 3 mois associée à un baisse d’audition > 25–30 dB, les aérateurs transtympaniques sont indiqués.
Surdité d’apparition brutale chez l’enfant de plus de 6 ans
La première cause est le bouchon de cérumen.
La deuxième cause est la surdité « psychogène ». Il s’agit d’une entité psychopathologique chez l’enfant, dans un contexte de somatisation. La plainte auditive rapportée – audiométries subjectives perturbées – n’est pas confirmée par les tests d’audiométrie objective.
Une fois ces causes éliminées, il faut évoquer une surdité de perception brusque et adresser le patient à un spécialiste ORL pour bilan et traitement.
L’apparition ou l’aggravation brutale de l’audition à tympan normal doit faire rechercher une mal-formation de l’oreille interne ou une autre pathologie de l’oreille interne.
Neuropathies auditives
Il s’agit d’une surdité de perception consécutive à des troubles auditifs atteignant la synapse intracochléaire, le nerf auditif ou le système central.
Ces surdités ont une présentation clinique atypique : discordance entre la tonale (perception de bruit possible) et la vocale (intelligibilité de la parole médiocre), discordance entre les différents examens objectifs (OEAP présentes et PEA perturbés). Dans certains cas, la surdité s’aggrave lorsque l’enfant est fébrile en raison du caractère thermosensible de certains médiateurs cochléaires. Ces enfants sont particulièrement gênés dans le bruit et ont besoin de supports visuels en complément de leur audition.
La prématurité, l’hyperbilirubinémie, le retard psychomoteur sont des facteurs de risque de ces surdités. Le dépistage en néonatologie doit se faire impérativement avec les PEAA.
L’otite séreuse est la première cause de surdité de transmission chez l’enfant d’âge < 6 ans, avec un retentissement possible sur les acquisitions linguistiques en cas d’évolution prolongée.
Les surdités neurosensorielles permanentes sont d’origine génétique dans 80 % des cas.
L’infection maternofœtale à CMV est la première cause de surdité congénitale non génétique.
III. Dépistage des anomalies orthopédiques
A. Pour bien comprendre
La majorité des anomalies orthopédiques de l’enfant ne sont responsables d’aucune symptomatologie fonctionnelle. Il convient d’être systématique dans le dépistage et vigilant à tous âges car certaines pathologies sont spécifiques d’une tranche d’âge.
La luxation congénitale de hanche (LCH) et les déformations du rachis (scoliose, cyphose) constituent un enjeu de santé publique. Leur diagnostic repose sur une stratégie de dépistage clinique systématique.
En l’absence de diagnostic et de traitement précoces, il existe un risque de séquelles lourdes engageant le pronostic fonctionnel. La prise en charge thérapeutique, si elle est trop tardive, peut aggraver considérablement le pronostic.
Les troubles d’axe des membres inférieurs sont un motif très fréquent d’inquiétude parentale, et donc de consultation.
Luxation congénitale de hanche, scoliose : une prise en charge trop tardive peut alourdir le pronostic.
B. Luxation congénitale de hanche
1. Généralités
La luxation congénitale de hanche concerne 3 à 4 enfants pour 1 000 naissances, avec un sexratio de 4 filles pour 1 garçon.
Il s’agit d’une anomalie anténatale de la hanche constituée de manière successive. La hanche est progressivement expulsée par pression continue sur le grand trochanter en rapport avec un conflit contenant/contenu (relatif gros bébé dans un utérus au volume réduit) qui se manifeste à la naissance par une instabilité de l’articulation, la stabilité de la hanche néonatale dépendant de la capsule qui a été distendue au cours du 3e trimestre.
Si de rares hanches instables se stabilisent en bonne place spontanément, la plupart, en l’absence de traitement adapté, restent luxées et s’aggravent progressivement au cours des premières semaines de vie.
Tout nouveau-né doit faire l’objet d’un dépistage clinique à la naissance. Ce dépistage doit être répété à chaque consultation médicale jusqu’à l’âge de la marche.
L’existence de facteurs de risque renforce cette obligation de dépistage. L’absence de facteur de risque ou la normalité des examens antérieurs ne dédouane en aucun cas de cette obligation de recherche à l’examen.
Facteurs de risque actuellement reconnus :
- les antécédents familiaux de LCH (au premier degré, diagnostic confirmé) ;
- la présentation en siège (y compris version tardive) et ce quel que soit le mode d’accouchement (c’est la position du bassin du bébé dans le pelvis de la mère qui explique le conflit).
Facteurs de risque secondaires (qui doivent augmenter la vigilance en l’absence d’augmentation réelle de l’incidence) :
- le bassin asymétrique congénital ;
- les anomalies posturales associées témoignant d’une contrainte anténatale importante (genu recurvatum, déformations posturales des pieds, torticolis).
Le dépistage de la luxation congénitale de hanche est clinique.
Il doit être répété lors de chaque examen, de la naissance à l’âge de la marche.
3. Dépister : comment ?
Principes
Le dépistage recherche deux signes cliniques importants : une limitation du volant d’abduction, une instabilité de la hanche (ou ressaut). On peut aussi noter une asymétrie des plis et une asymétrie de longueur des membres inférieurs (hanches et genoux à 90°).
L’enfant doit être examiné totalement déshabillé, sur un plan plat et dur. Il doit être aussi relâché que possible, calmé le cas échéant par une tétine ou un biberon. Si les conditions de relâchement optimal ne sont pas réunies, l’examen doit être répété ultérieurement (quelques heures à quelques jours).
Limitation d’abduction
Normalement, sur un nourrisson couché sur le dos, hanches fléchies à 90°, l’abduction égale ou dépasse 60° pour chaque hanche.
Une limitation de l’abduction (ou du volant d’abduction) en deçà de 60° constitue un signe indirect très important imposant le recours à l’imagerie. Dans tous les cas, au moindre doute, l’orthopédiste pédiatre doit être consulté (fig. 4.5).
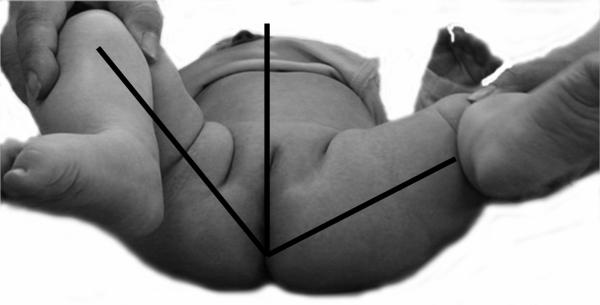
Fig. 4.5. ![]() Limitation d’abduction du côté droit.
Limitation d’abduction du côté droit.
Instabilité de la hanche
L’instabilité de la hanche doit être recherchée par la manœuvre de Barlow (fig. 4.6). C’est la tech-nique la plus sensible ; elle permet de dépister tous les types d’instabilité de hanche en examinant une hanche à la fois.
Dans un premier temps, la hanche est placée en adduction, en exerçant une pression axiale sur le genou (fig. 4.6A). La perception du ressaut traduit le franchissement par la tête fémorale du re-bord cotyloïdien. En fonction de l’importance de cet obstacle que franchit la tête fémorale, le ressaut sera plus ou moins bien perçu ; absent, il fait place à une sensation de « piston ».
La deuxième partie de la manœuvre consiste à placer la hanche en abduction, rotation interne, en exerçant une traction axiale et une pression sur le grand trochanter (fig. 4.6B). La perception d’un ressaut traduit le franchissement en sens inverse du rebord cotyloïdien par la tête fémorale, et donc le retour de la tête fémorale dans le cotyle.
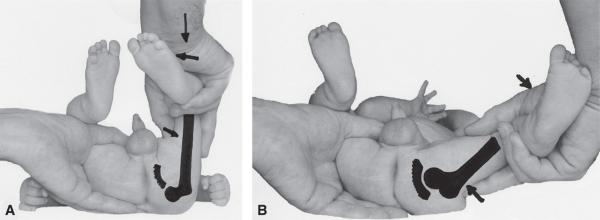
Fig. 4.6. ![]() Manœuvre de Barlow : examen de la hanche gauche d’un nourrisson.
Manœuvre de Barlow : examen de la hanche gauche d’un nourrisson.
A. La première partie de la manœuvre (pression axiale, adduction, rotation externe) provoque une luxation de la hanche perceptible par le ressaut sur le sourcil cotyloïdien. B. La seconde partie de la manœuvre (traction axiale, abduction, pression sur le grand trochanter) repositionne la tête fémorale à l’intérieur du cotyle avec la perception d’un ressaut de réduction.
Trois cas de figure sont possibles :
- hanche luxable : la hanche est en place spontanément ; la première partie de la manœuvre permet de percevoir un ressaut de luxation, la seconde partie un ressaut de réduction (ou réentrée) ;
- hanche luxée réductible : la hanche est luxée de sorte que la première partie de la manœuvre ne permet de percevoir aucun ressaut ; la seconde partie de la manœuvre permet de perce-voir un ressaut de réduction ; la hanche est réductible ;
- hanche luxée irréductible : la hanche est luxée ; on ne perçoit aucun ressaut, ni de luxation ni de réduction.
La limitation de l’abduction est constante en cas de luxation congénitale de hanche.
Le ressaut est le signe pathognomonique de l’instabilité de la hanche.
4. Indications de l’imagerie
L’examen clinique reste la seule méthode de « dépistage » d’une LCH.
L’échographie est l’examen de choix pour l’exploration d’une hanche avant l’apparition des noyaux épiphysaires. La radiographie n’a aucune place dans cette période et son indication n’est retenue qu’après l’apparition des noyaux épiphysaires.
La réalisation d’une échographie est indiquée si l’examen clinique retrouve une anomalie ou s’il existe un facteur de risque vrai (siège et/ou antécédent familial de LCH confirmé au premier de-gré). Après l’âge de 4 mois, c’est la radiographie qui pourra être réalisée.
Toute anomalie identifiée à l’imagerie requiert une prise en charge spécialisée.
5. Dépister : pourquoi ?
L’instabilité de la hanche peut être dépistée dès la naissance. Une prise en charge adaptée, de façon ambulatoire, dans les 3 premiers mois de vie permet d’obtenir dans la très grande majorité des cas une guérison complète et sans séquelles.
Le diagnostic de la luxation congénitale de hanche après l’âge de 3 mois et a fortiori devant une boiterie après l’âge de la marche (voir chapitre 70) est un échec du dépistage clinique. Plus l’enfant est âgé et plus la prise en charge devient longue et complexe avec des risques croissants de séquelles anatomiques au niveau de l’articulation.
C. Anomalies des axes des membres inférieurs
1. Préambule
L’ontogenèse est définie par l’évolution de l’anatomie de la conception au décès. Sa connaissance permet de comprendre qu’une situation anatomique normale à un âge peut être pathologique à un autre. De nombreux parents et médecins s’inquiètent à tort des axes des membres inférieurs de l’enfant au seul motif qu’ils sont différents de ceux d’un adulte.
Ces axes sont décrits dans le plan transversal (leur perturbation est responsable de troubles rotationnels) et dans le plan frontal (varus ou valgus).
2. Axes transversaux normaux et troubles rotationnels
Généralités
Au niveau du fémur il existe une antétorsion fémorale de 35° à 40° à la naissance. Elle diminue en moyenne de 1° à 2° par an jusqu’à la fin de la croissance. À maturité osseuse, l’antétorsion fémorale est comprise entre 10 et 15°.
Au niveau du tibia, la torsion est interne à la naissance, puis apparaît une torsion tibiale externe qui augmente progressivement jusqu’à 30° en fin de croissance.
Diagnostic d’un trouble de torsion
Pendant la marche, on regarde la position respective des genoux et des pieds. Normalement, lors de l’appui, le pied est dirigé en dehors (de 10° à 20° chez l’adulte) et la patella est vue de face. Leur positionnement en dedans de l’axe de marche est évocateur et peut être physiologique chez l’enfant.
La mesure clinique des rotations des membres inférieurs est faite sur un enfant placé en décubitus dorsal en bout de table, hanches étendues, jambes pendantes et genoux fléchis à 90°. On peut tester ainsi toutes les amplitudes articulaires et particulièrement les rotations au niveau de la hanche et au niveau du genou. En décubitus ventral, la manœuvre de Netter permet une estimation raisonnable de l’antéversion du col fémoral.
La combinaison des différents troubles de torsion (antéversion fémorale augmentée persistante et détorsion tibiale externe incomplète) donnera une marche en rotation interne le plus souvent chez le jeune enfant (fig. 4.7) avec parfois des chutes à répétition. Chez le plus âgé, la détorsion tibiale peut compenser l’antéversion fémorale excessive et cliniquement donner un angle de pas normal, tandis que la patella reste en dedans.
Ces excès ou insuffisances de torsion ont des conséquences dynamiques sur le cycle de la marche ou sur la course. Leur impact sur la démarche diminue avec l’âge, du fait de leur correction naturelle.
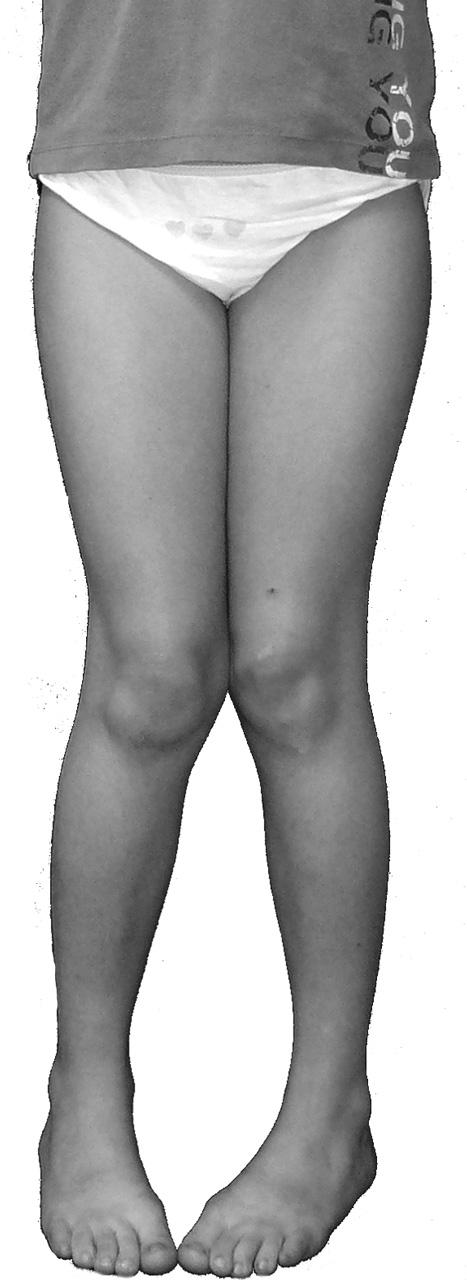
Fig. 4.7. ![]() Morphotype en torsion interne.
Morphotype en torsion interne.
Les patellas sont en dedans (excès de torsion fémorale interne), et les pieds sont en dedans par rapport aux patellas (défaut de torsion externe du squelette jambier).
Quand demander une consultation spécialisée ?
Une marche en rotation interne n’est pas pathologique en soi. Ce n’est qu’en cas d’abscence de rotation externe de hanche que le pronostic articulaire peut être remis en cause.
Aucun traitement orthopédique (rééducation, attelles, semelles orthopédiques) ne peut pré-tendre corriger ces défauts. La correction, qui ne peut être que chirurgicale, est réservée aux formes majeures (sans rotation externe de hanche).
3. Axes frontaux normaux et pathologiques
Généralités
Chez l’enfant arrivé à maturité, le centre de la tête fémorale, le centre du genou et le centre de la cheville se trouvent alignés (fig. 4.8C). Les condyles fémoraux et les chevilles sont au contact.
On parle de genu varum si la distance intercondylienne (DIC) est supérieure à 0 cm.
On parle de genu valgum si la distance intermalléolaire (DIM) est supérieure à 0 cm.
Le morphotype frontal physiologique évolue pendant la croissance en trois phases :
- de la naissance à l’âge de 3 ans : genu varum et torsion tibiale interne ; cela se corrige progressivement pour s’annuler entre 18 mois et 3 ans (fig. 4.8A) ;
- de l’âge de 3 ans à 10 ans : genu valgum ; il est maximal à l’âge de 3 ans chez la fille et 4 ans chez le garçon ; puis le valgus diminue progressivement jusqu’à la puberté (fig. 4.8B) ;
- à partir de la puberté chez les filles, le morphotype frontal est en léger genu valgum ; chez les garçons, il est aligné ou en très léger genu varum (< 2–3°).
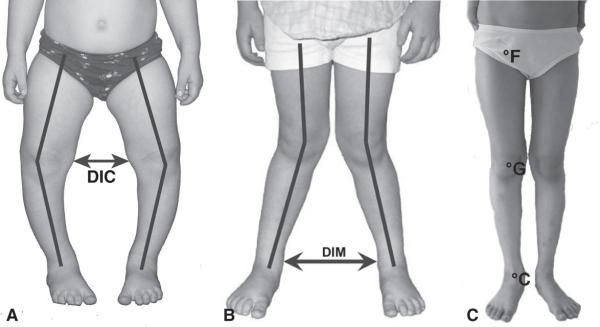
Fig. 4.8. ![]() Évolution du morphotype frontal des membres inférieurs.
Évolution du morphotype frontal des membres inférieurs.
A. Genu varum. La distance intercondylienne (DIC) est > 0. Ici le varus est évident mais on ne peut mesurer la DIC car les deux chevilles ne sont pas en contact. Situation physiologique de la naissance à 3 ans. B. Genu valgum. La distance intermalléolaire (DIM) est > 0. Situation physiologique de 3 ans à la phase prépubertaire. C. Morphotype aligné. Le centre de la tête fémorale (F), le centre du genou (G) et le centre de la cheville (C) se trouvent alignés. DIC = 0 cm et DIM = 0 cm. Situation physiologique à partir de la période pubertaire.
Quand demander des examens radiologiques et orienter vers une consultation spécialisée ?
Ces examens sont nécessaires lorsque les déformations sont observées en dehors des âges de leur normalité ou si elles sont très accentuées.
Ils s’imposent quel que soit l’âge si la déformation est asymétrique et/ou douloureuse.
Un genu varum amenait à identifier un rachitisme, chez les enfants n’ayant pas reçu une prophylaxie adaptée. Le plus souvent en France, il révèle un rachitisme vitamino-résistant ou une chondrodysplasie. La maladie de Blount conduit aussi à un genu varum uni- ou bilatéral.
Associés à une petite taille, le genu varum ou le genu valgum font rechercher une maladie osseuse constitutionnelle (achondroplasie, dysplasie polyépiphysaire…).
Morphotype frontal physiologique : genu varum jusqu’à 3 ans, genu valgum entre 3 et 10 ans.
D. Déformations du rachis de l’enfant et de l’adolescent
1. Préambule
Le diagnostic de ces déformations repose sur un dépistage clinique systématique.
La scoliose est une déformation du rachis dans les trois plans de l’espace (frontal, sagittal et horizontal) réalisant un segment de spire. Son diagnostic repose sur la mise en évidence de la gibbosité, pathognomonique de la scoliose structurale (vraie). C’est une déformation d’étiologie inconnue (idiopathique), plus fréquente chez la fille (4/1), qui la plupart du temps s’initie en tout début de puberté. Les causes secondaires plus rares sont : neurologiques ou neuromusculaires et con-génitales par malformation vertébrale.
La cyphose est une déformation dans le plan sagittal. Elle est le plus souvent « asthénique » et réductible, c’est-à-dire positionnelle chez l’adolescent. Elle est parfois associée à une dystrophie rachidienne de croissance qui se révèle au moment de la période de l’adolescence par une déformation caractéristique et parfois des plaintes douloureuses. Plus rarement, il peut s’agir d’une déformation congénitale.
2. Dépister : qui ?
Dans plus de 80 % des cas la scoliose est idiopathique et indolore. Le dépistage doit être réalisé de façon systématique à l’approche de l’adolescence.
La scoliose idiopathique concerne la fille dans 80 % des cas.
Certaines pathologies constituent des facteurs de risque accrus. Le diagnostic est le plus souvent évident (scoliose neuromusculaire, scoliose malformative dite congénitale, scoliose dystrophique de la neurofibromatose ou de la maladie de Marfan).
3. Dépister : pourquoi ?
La scoliose risque de s’aggraver avec la croissance et ce d’autant plus que la croissance staturale est rapide. Le risque est donc maximum en période pubertaire.
Une scoliose d’amplitude élevée (> 30°) peut se compliquer de douleurs précoces et chroniques à l’âge adulte, de troubles respiratoires (syndrome restrictif : diminution de la capacité vitale) et de troubles psychologiques liés à la « mal tolérance » d’un aspect dysmorphique.
L’objectif du dépistage est alors de permettre la mise en œuvre d’un traitement précoce afin de stabiliser la courbure et de conduire l’adolescent à la maturité pubertaire avec une déformation rachidienne de la plus faible amplitude possible.
Avant de conclure au caractère anorganique des douleurs rachidiennes de l’enfant, il faut re-chercher une raideur rachidienne qui pourra révéler une infection (spondylodiscite) ou une tumeur (osseuse ou intracanalaire). L’examen neurologique devra être systématique à la recherche d’une scoliose secondaire.
4. Dépister la scoliose : comment ?
Principes
La scoliose est une déformation de la colonne vertébrale visible dans un plan frontal (fig. 4.9) : asymétrie des épaules, asymétrie des plis de hanches. On vérifiera que le bassin est bien horizontal pour éviter le piège d’une attitude scoliotique bénigne.
L’enfant est examiné en position debout de face, de profil, de dos et en antéflexion.
Dans la très grande majorité des cas, la déformation se manifeste de profil par un applatissement ou un creusement du dos.
Dans le plan horizontal, il y a toujours une rotation des vertèbres autour de leur axe vertical (fig. 4.10A). C’est cette rotation qui se traduit cliniquement par la gibbosité (fig. 4.10B). Cette dé-formation est liée à la rotation vertébrale qui entraîne les côtes (au niveau dorsal) ou les masses musculaires (au niveau lombaire) du côté convexe vers l’arrière, créant une saillie bien visible en antéflexion de tronc.

Fig. 4.9. ![]() Scoliose double.
Scoliose double.
Radiographie du rachis de face, debout (le cliché est regardé vu de dos). Jeune fille de 14 ans présentant une courbure thoracique droite de 60° et une courbure lombaire gauche de 50°. Sa maturation pubertaire est déjà avancée. Elle n’a aucun phénomène douloureux mais la probabilité que sa scoliose s’aggrave à l’âge adulte est très importante. La déformation du rachis lombaire expose à un risque élevé de lombalgies. L’angle de Cobb est défini par les deux lignes parallèles aux deux plateaux vertébraux les plus inclinés par rapport à l’horizontale. Ici T5–T11 pour la courbure thoracique et T12–L4 pour la cour-bure lombaire.
Gibbosité
Pour mettre en évidence la gibbosité, l’examinateur, assis, place l’enfant devant lui debout de dos. Il vérifie le bon équilibre du bassin (épines iliaques antérosupérieures de face ou fossettes iliaques de dos). Les mains de l’enfant sont jointes pour équilibrer les épaules. L’enfant se penche en avant, mains jointes pour toucher ses pieds (fig. 4.10B).
Le reste de l’examen précise le déséquilibre de hauteur des épaules, la saillie asymétrique des scapulas, le déséquilibre du tronc, dans le plan frontal par rapport au pli fessier, l’asymétrie des plis de la taille, la déviation de la ligne des épineuses. Il est indispensable enfin de préciser le stade de développement pubertaire (Tanner) et la maturité osseuse (test de Risser).
Avant d’affirmer le diagnostic de scoliose idiopathique, il convient de rechercher les stigmates cliniques d’une étiologie possible : hyperlaxité tissulaire et signes cliniques associés d’une maladie de Marfan, anomalie du revêtement cutané avec des taches café au lait évocatrices d’une neurofibromatose, angiome ou touffe pilleuse de dos sur la ligne médiane évocateurs d’une malformation médullaire ou vertébrale, anomalies de l’examen neurologique (asymétrie du tonus musculaire, asymétrie des réflexes, abolition des réflexes cutanés abdominaux…) qui nécessiteront le plus souvent des explorations complémentaires.
Le dépistage de la scoliose repose sur la mise en évidence d’une gibbosité. L’examen neurologique doit être systématique.
Ce qui n’est pas une scoliose : une attitude scoliotique (bassin équilibré ; pas de rotation vertébrale ; disparition de la déviation sur un cliché en décubitus).
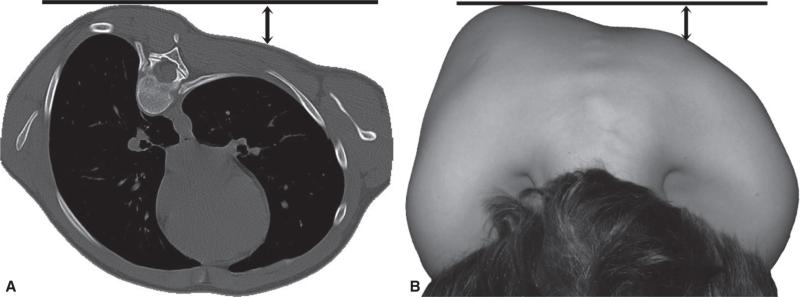
Fig. 4.10. ![]() Gibbosité thoracique.
Gibbosité thoracique.
A. TDM du rachis. Enfant ayant une scoliose thoracique droite. On note que la vertèbre thoracique est déviée vers la droite et que l’axe antéropostérieur de la vertèbre est orienté en avant et en dehors. Le corps vertébral est donc translaté à droite, alors que la ligne des épineuses reste proche de l’axe du tronc. Cette rotation de la vertèbre entraîne du côté droit la saillie des côtes en arrière à droite. B. Aspect clinique de la gibbosité chez le même patient. Quand l’enfant est placé en antéflexion, face à l’opérateur, le regard tangentiel permet de voir une image similaire à la coupe TDM. Le relief costal du côté droit réalise la gibbosité.
Premier bilan d’imagerie
Il comporte une radiographie du rachis en entier de dos/face et de profil en position debout (fig. 4.9). Cette radiographie permettra de calculer l’angle de Cobb dont l’évaluation facilite la surveillance de la scoliose et son évolutivité. Le cliché de profil met en évidence les courbures sagittales. Il n’est pas nécessairement répété au cours de la surveillance. La technique de radio-graphie numérisée EOS permet d’avoir une imagerie moins irradiante, idéale dans le cadre du suivi.
5. Attitude pratique en cas de scoliose
Si la déformation est de faible amplitude (angle de Cobb < 15°) et si l’enfant est encore en période de croissance, une réévaluation clinique et radiologique est indispensable dans un premier temps avec un rythme semestriel, espacé progressivement. Cette surveillance permet de dépister l’évolutivité de la scoliose.
En cas d’évolutivité, le recours au spécialiste orthopédiste pédiatre est indispensable.
6. Dépister la cyphose : comment ?
La cyphose est une déformation du rachis dans le plan sagittal. Le plus souvent, il s’agit d’une augmentation de la cyphose physiologique du secteur thoracique (fig. 4.11A), mais il peut aussi s’agir d’une diminution voire d’une inversion de la lordose du secteur cervical ou du secteur lombaire.
Les conséquences de cette seule déformation sont essentiellement disgracieuses, mais aussi douloureuses à l’adolescence ou à l’âge adulte.
La dystrophie rachidienne de croissance (maladie de Scheuermann) est la première cause de cyphose de l’adolescent (fig. 4.11B).
Les autres causes (malformation congénitale ou maladie osseuse constitutionnelle) s’inscrivent dans un contexte d’évaluation spécialisée.
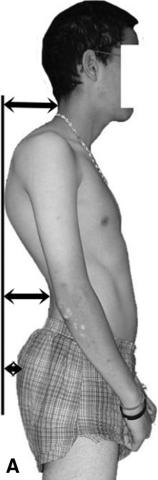
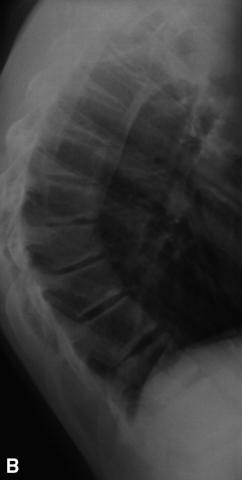
Fig. 4.11. ![]() Cyphose de dystrophie rachidienne de croissance.
Cyphose de dystrophie rachidienne de croissance.
A. Cyphose thoracique chez un adolescent. Elle est mesurée cliniquement par les flèches des processus épineux au plus creux de chaque lordose cervicale et lombaire. Cet adolescent a des douleurs du rachis thoracique en rapport avec sa dystrophie osseuse. À l’âge adulte il risque de souffrir de cervicalgies ou de lombalgies en rapport avec les hyperlordoses compensatrices qu’il développe. B. Radiographie du rachis de profil, debout. Images de dystrophie rachidienne de croissance (maladie de Scheuermann) chez le même patient. Les plateaux vertébraux sont irréguliers et ont perdu leur parallélisme.
Références
Ce chapitre a bénéficié d’une relecture par le Collège des Ophtalmologistes Universitaires de France (COUF) et le Collège Français d’ORL pour s’assurer de l’absence de discordances entre les documents de référence proposés. Plus d’objectifs sont traités dans les Référentiels de spécialités reliés.

|
Carnet de santé (modèle 2018). https://solidarites-sante.gouv.fr/IMG/pdf/carnet_de_sante-num-.pdf |

|
HAS. Pose d’aérateurs transtympaniques dans l’otite moyenne séreuse et séromuqueuse chronique bilatérale chez l’enfant. 2017. https://www.has-sante.fr/upload/docs/application/pdf/2017-04/dir1 app-17_fiche_pertinence_att_cd_2017_03_22_vfinale.pdf |

|
HAS. Rapport d’élaboration sur la luxation congénitale de la hanche. 2013. http://www.has-sante.fr/portail/upload/docs/application/pdf/2013-11/doc… |

|
ANAES. Dépistage précoce des troubles de la fonction visuelle chez l’enfant pour prévenir l’amblyopie. 2002. http://www.has-sante.fr/portail/jcms/c_267412/depistage-amblyopie-recom… |

|
SFP, DGS. Dépistage des troubles de l’audition chez l’enfant : guide pratique. 2009. http://social-sante.gouv.fr/IMG/pdf/Depistage_des_troubles_de_l_auditio… |

|
Simon F. Otites séreuses chez l’enfant. Pas à pas en pédiatrie. Arbres décisionnels commentés des Sociétés de pédiatrie. 2020. https://pap-pediatrie.fr/orl/otite-sero-muqueuse-chez-lenfant |
