Objectifs pédagogiques
- Expliquer la physiopathologie de l’asthme et de la rhinite.
- Diagnostiquer une hypersensibilité respiratoire chez l’enfant et chez l’adulte.
- Diagnostiquer un asthme de l’enfant et de l’adulte.
- Identifier les situations d’urgence et planifier leur prise en charge.
- Connaître les grands principes thérapeutiques de fond de la maladie asthmatique.
- Identifier le caractère professionnel d’une allergie respiratoire : démarche dia-gnostique étiologique, éviction du risque.
Avant de commencer…
Spécificités de l’asthme pédiatrique :
- toujours évoquer les diagnostics différentiels :
- recherche de signes d’alerte, notamment : ralentissement staturo-pondéral, absence d’intervalles libres et résistance à un traitement bien conduit ;
- prescription systématique d’une radiographie de thorax ;
- réalisation d’EFR (VEMS ou DEP possible à partir de l’âge de 6 ans) et de tests cutanés allergologiques (systématique dès l’âge de 3 ans car fréquence élevée des comorbidités allergiques) ;
- nécessité absolue d’adapter la méthode d’inhalation aux capacités de l’enfant ;
- traitement de fond de première intention par une corticothérapie inhalée à faible dose ;
- absence d’AMM pour les bronchodilatateurs de longue durée d’action avant l’âge de 4 ans ;
- grande fréquence des non-prises (défaut d’observance) ou des mauvaises prises (défauts tech-niques) médicamenteuses dans les échecs apparents de traitement.
Particularités supplémentaires pour l’enfant préscolaire (moins de 5 ans) :
- vigilance accrue vis-à-vis des diagnostics différentiels ;
- rôle majeur des infections virales dans le déclenchement des exacerbations ;
- critères de mise sous traitement et de contrôle différents ;
- nécessité d’ajouter un masque facial à la chambre d’inhalation avant 4 ans, possible recours à des nébulisations à domicile.
I. Généralités
A. Définition
La définition de l’asthme est commune aux adultes et aux enfants.
Il s’agit d’une maladie hétérogène, caractérisée par une inflammation chronique des voies aériennes. Elle se définit par des épisodes récidivants de symptômes respiratoires tels que sifflements, dyspnée, toux et oppression thoracique, qui varient dans le temps et en intensité, et s’accompagnent d’une limitation variable des débits expiratoires (trouble ventilatoire obstructif variable) (GINA 2022).
L’intensité et la durée des symptômes permettent de distinguer les crises ou exacerbations (symptômes aigus intenses et/ou prolongés), de symptômes moins intenses et moins prolongés, présents dans le quotidien ou à l’effort, et reflétant le contrôle de l’asthme.
B. Épidémiologie et facteurs de risque
1. Épidémiologie
L’asthme est la maladie chronique la plus fréquente chez l’enfant.
En France, la prévalence de l’asthme chez les enfants est d’environ 10 %. Chez le jeune enfant, elle est plus élevée chez les garçons que chez les filles. Cette tendance s’inverse à l’adolescence.
L’exacerbation (ou crise) d’asthme est l’une des premières causes de consultation aux urgences pédiatriques et d’hospitalisation.
La mortalité par asthme chez les enfants est de 10 à 15 décès par an.
2. Facteurs de risque
L’existence d’antécédents familiaux au premier degré d’asthme ou de maladies atopiques (dermatite atopique, allergie alimentaire IgE-médiée, rhinoconjonctivite allergique) est un facteur de risque d’asthme.
Le tabagisme in utero et dans la petite enfance, l’obésité de la femme enceinte, l’obésité de l’enfant et l’exposition aux moisissures sont des facteurs de risque d’asthme à l’âge scolaire.
La présence de sensibilisations et celle d’allergies respiratoires (rhinite allergique) et alimentaires sont associées au développement, à la persistance et à la sévérité de l’asthme de l’enfant.
L’hyperréactivité bronchique, le sexe féminin et un tabagisme actif précoce sont les autres facteurs principaux de persistance de l’asthme après l’adolescence.
De nombreux facteurs jouent un rôle dans le déclenchement des symptômes.
Les infections respiratoires, surtout virales, sont reconnues comme un facteur déclenchant les symptômes d’asthme et comme un facteur induisant une hyperréactivité bronchique durable, notamment chez le nourrisson.
Concernant les allergies respiratoires : les pneumallergènes le plus souvent impliqués dans les manifestations asthmatiques sont les acariens, les animaux domestiques (chats, chiens) et les pollens (bouleau, graminées en particulier).
L’exercice entraîne un bronchospasme chez plus de 80 % des enfants asthmatiques ; l’inhalation buccale d’air froid et sec joue un rôle important dans son déclenchement.
Les polluants de l’environnement intérieur (au premier rang desquels le tabagisme parental) et extérieur, les changements de climat peuvent également favoriser le déclenchement des symptômes d’asthme.
Asthme : obstruction diffuse et variable des voies aériennes (bronches, bronchioles), réversible sous bronchodilatateurs
II. Démarche diagnostique
A. Établir le diagnostic d’asthme
Le diagnostic d’asthme repose sur un faisceau d’arguments.
1. Symptômes évocateurs
Il s’agit notamment des symptômes suivants : toux, dyspnée expiratoire, sifflements, sensation d’oppression thoracique. Leurs caractéristiques sont résumées dans le tableau 57.1.
Ces derniers sont particulièrement évocateurs lorsqu’il existe un terrain atopique personnel et/ou familial au premier degré (antécédents d’asthme allergique, de dermatite atopique, de rhinoconjonctivite allergique, d’allergie alimentaire IgE-médiée).
Tableau 57.1. ![]() Arguments pour un diagnostic d’asthme chez l’enfant.
Arguments pour un diagnostic d’asthme chez l’enfant.
| Symptômes | Caractéristiques suggérant un asthme |
|---|---|
| Toux |
|
| Sifflement (wheezing) |
|
| Dyspnée |
|
| Limitation des activités |
|
| Examen clinique |
|
| Épreuve thérapeutique |
|
| Variabilité dans le temps |
|
Éléments évocateurs : dyspnée expiratoire, toux, wheezing (sifflements), sibilants auscultatoires.
Facteurs déclenchants principaux des symptômes d’asthme chez l’enfant : infections virales et exposition aux allergènes.
Rechercher : périodes intercritiques asymptomatiques (notamment en été).
2. Syndrome obstructif variable
La réalisation d’épreuves fonctionnelles respiratoires (EFR) est importante dès que l’enfant est capable de coopérer, c’est-à-dire à partir de l’âge de 3 ou 4 ans. Avant cet âge, seuls les arguments cliniques et la réponse au traitement vont permettre d’affirmer le diagnostic d’asthme. Les EFR peuvent apporter des arguments positifs pour le diagnostic d’asthme (tableau 57.2). Les anomalies ne sont pas systématiques chez l’enfant et il est important de noter que les EFR sont le plus souvent normales chez l’enfant asthmatique en dehors d’un épisode aigu.
À partir de l’âge de 6 ans, l’enfant est capable de réaliser des manœuvres respiratoires forcées comme l’adulte. Une courbe débit-volume peut donc être effectuée.
Entre les âges de 3 et 6 ans, l’enfant est le plus souvent incapable de réaliser des manœuvres respiratoires forcées. Une obstruction des voies aériennes peut néanmoins être recherchée, en situation spontanée ou après provocation, par la mesure des résistances des voies aériennes (techniques de pléthysmographie corporelle, interruption du débit aérien, oscillations forcées). Ces techniques se font au cours de la ventilation spontanée, sont facilement réalisables, mais ne souvent disponibles en ambulatoire que chez les pneumopédiatres ou dans les laboratoires hospitaliers d’explorations pédiatriques.
Les EFR sont en faveur du diagnostic d’asthme en cas de mise en évidence d’un syndrome obstructif variable dans le temps (voir supra). Le test de provocation à la métacholine est rarement utile au diagnostic lorsque les symptômes sont typiques et en l’absence d’argument pour un diagnostic différentiel. Il peut être utile pour aider au diagnostic d’asthme lorsque celui-ci est douteux. La positivité du test à la métacholine indique l’existence d’une hyperréactivité bronchique.
Tableau 57.2. ![]() Mise en évidence d’un trouble ventilatoire obstructif et de sa variabilité (d’après : ERS Guidelines 2021).
Mise en évidence d’un trouble ventilatoire obstructif et de sa variabilité (d’après : ERS Guidelines 2021).
| Trouble ventilatoire obstructif | VEMS et VEMS/CVF < limite inférieure de la normale (= 5e percentile ou – 1,64 Z-score) |
| Réversibilité après inhalation d’un bronchodilatateur |
Augmentation du VEMS > 10 % par rapport à la valeur théorique |
| Test de provocation bronchique non spécifique (métacholine ou histamine) | Chute du VEMS d’au moins 20 % par rapport à la valeur basale |
| Test d’exercice | Chute du VEMS d’au moins 12 % par rapport à la valeur basale |
Source : Gaillard EA, Kuehni CE, Turner S, et al. European Respiratory Society clinical practice guidelines for the diagnosis of asthma in children aged 5-16 years. European Respiratory Journal 2021;58:2004173.
B. Exclure les diagnostics différentiels
Des épisodes de dyspnée sifflante peuvent révéler d’autres pathologies que l’asthme.
Les signes d’alerte évocateurs de diagnostics différentiels à rechercher à tout âge sont :
- un terrain particulier :
- prématurité → dysplasie bronchopulmonaire ;
- cardiopathie connue ;
- début très précoce, dès le 1er mois de vie → anomalie congénitale ;
- l’absence d’intervalles libres entre les exacerbations, avec des signes intercritiques de type « asthmatique » ou non :
- toux sans rémission, wheezing continu ;
- stridor, cornage → atteinte laryngée ou trachéale ;
- dyspnée aux deux temps → atteinte trachéale ;
- bronchorrhée → bronchopathie chronique ;
- l’absence de rythmicité des symptômes par les déclencheurs habituels de l’asthme ;
- une déformation thoracique ;
- un hippocratisme digital → mucoviscidose, autre cause d’insuffisance respiratoire chronique ;
- des signes extrarespiratoires associés :
- souffle cardiaque, dyspnée d’effort → cardiopathie congénitale ;
- ralentissement pondéral et/ou statural, diarrhée chronique → mucoviscidose ;
- fausses routes → fistule œsotrachéale, troubles de déglutition ;
- infections ORL bactériennes fréquentes → dyskinésie ciliaire primitive, déficit immunitaire ;
- l’échec des mesures thérapeutiques bien conduites (absence de réponse aux bronchodilatateurs ou aux corticoïdes inhalés) ;
- l’existence d’anomalie de la radiographie de thorax, qui doit être systématiquement réalisée à tout âge (cliché de face en inspiration ± cliché en expiration en cas de doute sur une asymétrie).
Les données de l’anamnèse et du carnet de santé, l’examen physique vont souvent permettre de s’orienter vers ces diagnostics différentiels (tableau 57.3).
Tableau 57.3. ![]() Principaux diagnostics différentiels de l’asthme de l’enfant.
Principaux diagnostics différentiels de l’asthme de l’enfant.
| Atteinte des voies aériennes hautes (ORL) | – Syndrome d’hyperventilation – Dyskinésie des cordes vocales – Anomalies dynamiques (laryngomalacie) |
| Obstruction des voies aériennes proximales | – Anomalies dynamiques ou constitutionnelles des voies aériennes (trachéomalacie, bronchomalacie, sténose) – Corps étranger inhalé – Compression extrinsèque par processus malformatifs (anomalie des arcs aortiques, kyste bronchogénique) – Compression extrinsèque par processus acquis (tumeur, adénopathie notamment tuberculeuse) |
| Obstruction des petites voies aériennes | – Mucoviscidose – Dysplasie bronchopulmonaire – Dyskinésie ciliaire primitive – Bronchiolite oblitérante (séquelle de virose) – Autre bronchopneumopathie chronique obstructive de l’enfant |
| Pathologie d’inhalation | – Reflux gastro-œsophagien – Fistule œsotrachéale – Troubles de déglutition |
| Déficits immunitaires | – Bronchopathies chroniques avec exacerbations à type de surinfections fréquentes – Pneumopathies chroniques |
| Cardiopathie congénitale | – Shunt gauche-droite – Cardiomégalie |
Poser le diagnostic d’asthme de l’enfant nécessite l’exclusion des diagnostics différentiels.
Rechercher les signes d’alerte évocateurs d’un diagnostic différentiel et faire une radiographie du thorax systématiquement.
C. Prescrire les examens complémentaires utiles
1. Radiographie thoracique
Une radiographie de thorax est effectuée chez tout enfant asthmatique. Elle doit être normale en période intercritique. L’existence d’anomalie peut orienter vers un diagnostic différentiel.
2. Enquête et tests immuno-allergologiques
L’asthme de l’enfant scolaire a majoritairement un profil allergique et est fréquemment associé aux autres comorbidités allergiques (rhinite allergique, allergie alimentaire IgE-médiée, dermatite atopique).
L’exploration allergologique est susceptible d’identifier des facteurs déclenchants.
L’anamnèse permet d’établir un lien entre exposition allergénique et la survenue de symptômes, et elle oriente le bilan allergologique.
Recommandations de réalisation d’une enquête allergologique :
• chez tout asthmatique âgé de plus de 3 ans ;
• chez l’asthmatique âgé de moins de 3 ans ayant : des signes respiratoires persistants et/ou récidivants et/ou sévères, et/ou nécessitant un traitement continu, et/ou associés à des signes extrarespiratoires compatibles avec une origine allergique.
Les prick-tests aux pneumallergènes courants (acariens, animaux domestiques, pollens) sont recommandés en première intention (voir chapitre 58).
Le dosage des IgE spécifiques des pneumallergènes n’est recommandé qu’en cas de discordance entre la clinique et les résultats des prick-tests ou en l’absence de prick-tests.
3. Autres examens complémentaires
En cas de doute avec un diagnostic différentiel, d’autres examens paracliniques orientés sont réalisés :
- TDM thoracique injectée : bronchopathie, séquelle de virose, dilatation des bronches, compression ;
- pH-métrie : RGO (facteur aggravant possible) ;
- test de la sueur : environ 3 et 3,5 % de faux négatifs au test de dépistage ;
- endoscopie bronchique : lavage broncho-alvéolaire et biopsie de muqueuse bronchique pour analyse de l’inflammation et du remodelage ;
- bilan de première intention de déficit immunitaire : NFS, IgG/IgA/IgM, sérologies vaccinales.
Enquête allergologique : anamnèse et prick-tests cutanés en première intention.
III. Évaluation de l’asthme
Elle repose sur une évaluation clinique et fonctionnelle (EFR). Cette évaluation détermine le niveau de sévérité de l’asthme ainsi que le niveau thérapeutique nécessaire.
A. Évaluation clinique (tableau 57.4)
Elle est fondée sur :
- l’évaluation des symptômes :
- nombre et sévérité des crises d’asthme au cours des derniers mois ou depuis la précédente consultation ;
- évaluation du contrôle de l’asthme sur les 4 semaines précédant la consultation ; des scores de contrôle type ACT (Asthma Control Test) sont utiles ; les critères de non-contrôle sont différents chez l’enfant préscolaire et celui d’âge scolaire ;
- l’estimation du risque d’exacerbations ultérieures.
Tableau 57.4 . ![]()
![]() Évaluation du contrôle de l’asthme (4 dernières semaines) chez l’enfant (adapté de GINA 2022) et recherche des facteurs de risque d’exacerbation ultérieure.
Évaluation du contrôle de l’asthme (4 dernières semaines) chez l’enfant (adapté de GINA 2022) et recherche des facteurs de risque d’exacerbation ultérieure.
| Bon contrôle | Contrôle partiel | Mauvais contrôle | ||
|---|---|---|---|---|
| Contrôle des symptômes | ||||
| Symptôme | Critère de non-contrôle | |||
| Symptômes d’asthme dans la journée | > 1/semaine (0 à 5 ans) > 2/semaine (≥ 6 ans) |
Aucun de ces critères | 1–2 critères | 3–4 critères |
| Symptômes nocturnes | Au moins 1 réveil nocturne lié à l’asthme (tous âges) Au moins 1 accès de toux liée à l’asthme (0 à 5 ans) |
|||
| Utilisation d’un bronchodilatateur de secours |
> 1/semaine (0 à 5 ans) > 2/semaine (≥ 6 ans) |
|||
| Comportement lors d’activités | Toute limitation aux activités liée à l’asthme | |||
| Recherche des facteurs de risque d’exacerbation ultérieure | ||||
|
|
||||
SAHOS : syndrome d’apnées-hypopnées obstructives du sommeil.
B. Évaluation fonctionnelle
Au cours du suivi, les EFR sont répétées 3 à 6 mois après la mise en route ou la modification d’un traitement, puis au moins une à deux fois par an selon la sévérité de l’asthme. Elles permettent de suivre l’évolution du VEMS et de rechercher une réversibilité.
L’existence d’une obstruction et/ou celle d’une réversibilité sont des facteurs de risque de survenue de crises d’asthme (tableau 57.4).
IV. Prise en charge d’une crise (ou exacerbation) d’asthme
A. Diagnostic
La crise d’asthme (ou exacerbation) représente une aggravation des symptômes et de la fonction respiratoire par rapport à l’état habituel du patient, suffisamment importante pour nécessiter une modification du traitement habituel.
Les crises sont caractérisées par une augmentation plus ou moins brutale ou progressive des symptômes (toux, dyspnée, sifflements, oppression thoracique). La dyspnée est expiratoire, avec sibilants, récidivante, variable dans le temps, et partiellement ou totalement réversible sous bronchodilatateur. La crise se prolonge habituellement plus de 24 heures.
Les facteurs déclenchants sont : les infections virales, les allergènes, l’exposition à des polluants ou irritants, les changements de climat, la mauvaise observance du traitement de fond.
La crise d’asthme peut survenir chez un asthmatique déjà connu, quelle que soit la sévérité de l’asthme, et peut aussi être la manifestation révélatrice de l’asthme.
B. Appréciation de la gravité des signes cliniques
L’évaluation initiale permet de définir la gravité de la crise.
Les éléments à évaluer sont : les symptômes et leur sévérité (voir infra), leur moment d’apparition, leur cinétique d’aggravation, les facteurs déclenchants, la réponse aux bronchodilatateurs. Cette évaluation permet de déterminer si l’exacerbation peut être gérée dans un contexte de soins primaires ou si un transfert en milieu hospitalier est nécessaire.
Les éléments cliniques imposant un transfert hospitalier (GINA 2022) sont :
- troubles de conscience ;
- silence auscultatoire ;
- difficulté d’élocution : parle par mots, assis penché en avant, agité ;
- polypnée : FR > 40/min avant 6 ans, FR > 30/min à partir de 6 ans ;
- mobilisation des muscles accessoires ;
- tachycardie : FC > 180/min jusqu’à 3 ans ; FC > 150/min à 4–5 ans ; FC > 120/min à partir de 6 ans ;
- SpO2 (en air) < 92 % avant 6 ans ; < 90 % à partir de 6 ans ;
- DEP ≤ 50 % de la valeur théorique ou optimale de l’enfant ; la mesure du débit expiratoire de pointe (DEP, ou peak-flow) est théoriquement réalisable à partir de 6 ans, mais en pratique rarement utilisée en situation aiguë chez l’enfant.
La présence de signes de crise grave nécessite une évaluation médicale, hospitalière, avec surveillance de plusieurs heures pour juger de l’évolution.
Une hospitalisation est nécessaire lorsqu’une amélioration franche n’est pas observée après une prise en charge thérapeutique aux urgences pédiatriques. Les critères d’hospitalisation doivent également tenir compte du terrain de l’enfant et de ses antécédents (notamment des facteurs de risque d’exacerbation), ainsi que des critères non spécifiques de recours aux soins et d’environnement social.
C. Indications des examens complémentaires
Leur prescription n’est pas systématique lors d’une crise d’asthme.
La radiographie du thorax de face est indiquée en cas :
- de premier épisode inaugural (réalisation immédiate ou à distance selon évolution) ;
- de fièvre associée ;
- d’anomalies auscultatoires persistantes après prise en charge (crépitants localisés, asymétrie auscultatoire) ;
- de crise sévère justifiant une hospitalisation.
Elle peut montrer : une distension thoracique, une complication (atélectasie, pneumopathie, pneumothorax, pneunomédiastin) ou des arguments pour un diagnostic différentiel.
Des examens biologiques ne sont pratiqués que s’ils ont un intérêt pour la prise en charge : NFS, CRP en cas de sepsis, ionogramme sanguin à la recherche de troubles d’hydratation et d’hypokaliémie (administration importante de 2-mimétiques en cas d’asthme aigu grave), recherche d’une hypercapnie par gazométrie en cas d’indication de transfert en réanimation.
D. Initiation du traitement de la crise d’asthme
La prise en charge d’une crise d’asthme constitue une urgence thérapeutique.
1. β2-mimétiques de courte durée d’action (β2CA)
C’est le traitement de première intention de la crise d’asthme quel que soit le niveau de gravité.
Les principales molécules utilisées sont le salbutamol et la terbutaline.
Modes d’administration possibles :
- aérosols-doseurs avec chambre d’inhalation : 2–6 bouffées chez l’enfant d’âge préscolaire (< 6 ans) et 4–10 bouffées chez l’enfant d’âge scolaire (6 ans et plus) ;
- nébulisations avec 6–8 litres d’oxygène (a l’avantage de ne nécessiter aucune coopération de l’enfant et est à privilégier en cas de crise sévère avec hypoxémie) : 1 dosette de 2,5 mg (≤ 16 kg) ou 5 mg (> 16 kg) équivalent salbutamol.
L’administration est répétée toutes les 20 minutes pendant 1 heure. La situation clinique doit ensuite être réévaluée, et ce même schéma thérapeutique répété selon l’amélioration ou non des symptômes.
2. Corticothérapie générale
Les indications de la corticothérapie générale sont la persistance de la crise depuis 2 ou 3 jours ou la mauvaise réponse aux bronchodilatateurs, la cinétique d’aggravation rapide, les antécédents de crise brutales (GINA 2022).
La voie préférentielle est la voie orale. La voie parentérale est utilisée chez les enfants incapables d’ingérer ce traitement (vomissements, troubles de la conscience).
Les principales molécules utilisées sont : la bétaméthasone chez les nourrissons, la prednisolone chez les enfants plus âgés. La durée de traitement est de 3 à 5 jours.
La corticothérapie inhalée n’est pas le traitement de la crise d’asthme.
3. Autres traitements
Traitement symptomatique
La mise en condition d’une crise grave évaluée en milieu hospitalier impose : une libération des voies aériennes, la mise en position semi-assise, un monitoring cardiorespiratoire, une oxygénothérapie adaptée à la saturation en oxygène.
Des signes de gravité extrêmes doivent faire poser un abord veineux et prévenir le réanimateur.
Anticholinergiques de synthèse
Le bromure d’ipratropium est un bronchodilatateur indiqué dans les crises graves comme traitement additionnel aux 2CA, et dans la 1re heure de traitement.
Autres ressources thérapeutiques
Certains traitements sont réservés aux crises sévères, avec indication de passage en unité de soins critiques : sulfate de magnésium IV, salbutamol en nébulisations continues ou en IV.
La kinésithérapie respiratoire n’est pas indiquée dans la crise d’asthme.
Les agents mucolytiques ne sont pas recommandés, et même contre-indiqués chez le nourrisson. Les sédatifs sont contre-indiqués.
L’antibiothérapie est rarement indiquée, même si la crise d’asthme est sévère ou fébrile. En effet, les virus représentent le facteur déclenchant principal de la crise d’asthme chez l’enfant.
Urgence thérapeutique.
Traitement de crise de première intention = 2-mimétiques de courte durée d’action.
Corticothérapie orale immédiate indispensable si crise d’asthme grave.
4. Conduite pratique
L’algorithme proposé (fig. 57.1) synthétise la conduite à tenir en pratique en cas de crise d’asthme chez l’enfant d’âge ≥ 6 ans (GINA 2022).
Critères de retour au domicile après un traitement initial :
- FR ≤ 30/min (si âge ≥ 2 ans), absence de signes de lutte respiratoire, ventilation spontanée en air ambiant ;
- enfant exprimant qu’il se sent bien (si en âge de parler) ;
- DEP ≥ 70 % de la théorique de l’enfant (si maîtrise de la technique) ;
- compréhension du traitement de sortie, proximité d’un hôpital en cas de récidive.
L’ordonnance de sortie pour une crise d’asthme non hospitalisée comprend la poursuite des inhalations de 2CA pendant 5 à 7 jours (jusqu’à disparition des symptômes) et des corticoïdes oraux (si prescrits).
Fig. 57.1. ![]() Conduite à tenir en cas de crise d’asthme chez un enfant à partir de l’âge de 6 ans.
Conduite à tenir en cas de crise d’asthme chez un enfant à partir de l’âge de 6 ans.
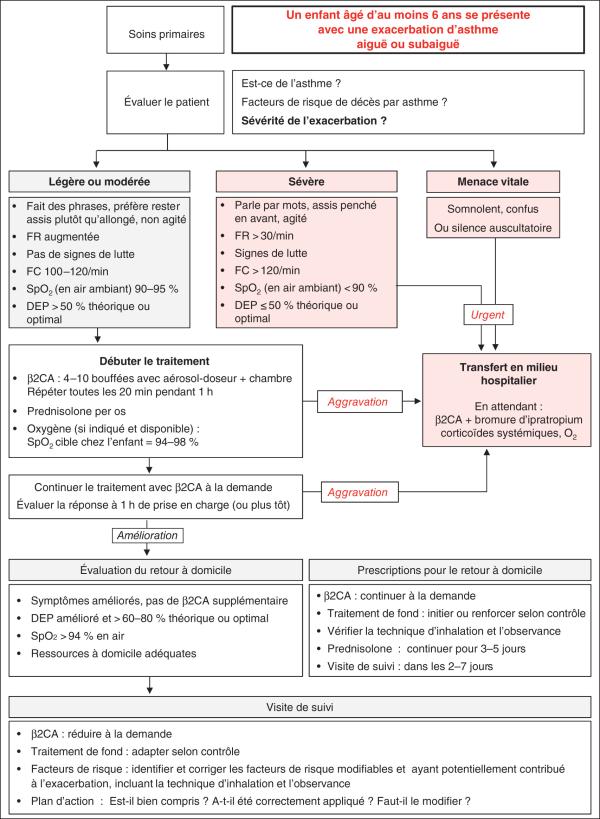
D’après : GINA 2023, Report, Global Strategy for Asthma Management and Prevention.
Un traitement de fond doit être commencé au décours d’une crise d’asthme hospitalisée et poursuivi pour une durée d’au moins 3 mois.
La décision de retour à domicile doit s’accompagner d’explications à propos des techniques d’inhalation, de conseils de prévention de futures crises (éviction des facteurs déclenchants) et de la conduite à tenir en cas de réapparition des symptômes (plan d’action).
β2CA ± corticoïdes per os, consignes de surveillance et plan d’action expliqués.
Éducation thérapeutique indispensable. PAI en collectivité.
5. Plan d’action d’autogestion de l’exacerbation d’asthme
Un plan d’action écrit doit être remis à tous les enfants et adolescents asthmatiques dans le but de guider l’enfant ou sa famille à reconnaître et traiter une crise d’asthme.
Il doit être individualisé, prenant en compte le niveau de contrôle.
Contenu du plan d’action :
- les signes cliniques à identifier, dont ceux nécessitant d’appeler des secours ;
- les médicaments de secours à utiliser (posologie) ;
- les indications de recours à une consultation médicale urgente.
Avis médical en cas de crise ne cédant pas après application du plan d’action personnalisé.
Crise grave en cas de : silence auscultatoire, troubles d’élocution, SpO2< 92 % avant 6 ans ou < 90 % à partir de 6 ans.
V. Traitement de fond de l’asthme
A. Objectifs
Objectifs de la prise en charge au long cours de l’asthme :
- contrôler les symptômes ;
- éviter les crises d’asthme ;
- préserver la fonction respiratoire ;
- maintenir des activités normales (scolarité, activité physique) ;
- avoir une qualité de vie optimale (sommeil compris) ;
- utiliser la dose minimale efficace de corticoïdes inhalés pour limiter les effets secondaires liés aux traitements.
B. Principes (fig. 57.2)
La prise en charge au long cours de l’asthme repose sur la prescription de traitements médicamenteux (médicaments de secours en cas de symptômes, traitement de fond dès que les symptômes intercritiques sont suffisamment importants), l’éducation du patient et de sa famille, et sur l’utilisation d’un plan d’action écrit aidant à reconnaître et traiter une crise.
Une évaluation régulière est nécessaire pour adapter le traitement de fond, en fonction du contrôle obtenu.
Fig. 57.2. ![]() Stratégies thérapeutiques par paliers, en fonction de l’âge de l’enfant.
Stratégies thérapeutiques par paliers, en fonction de l’âge de l’enfant.
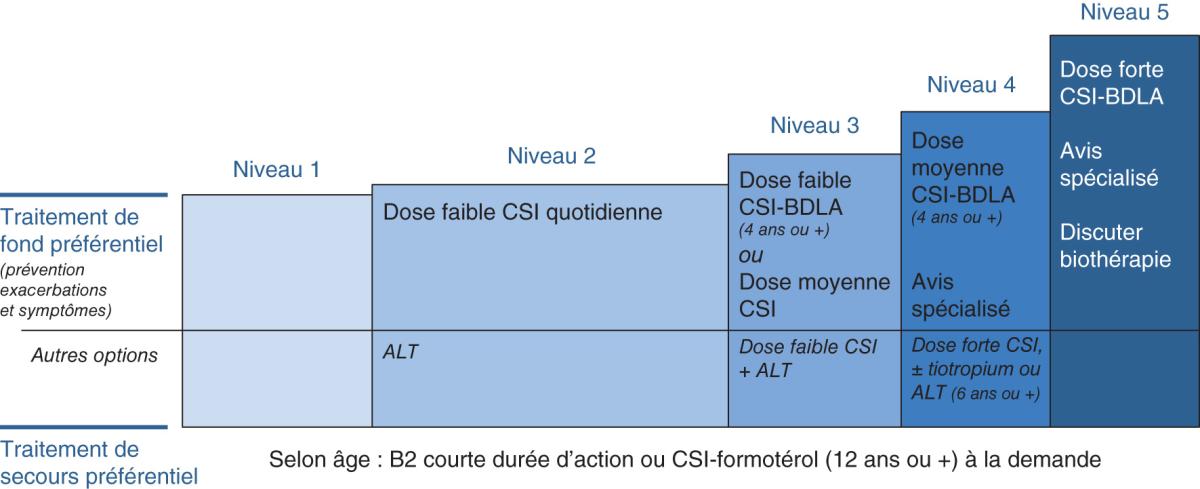
Chaque niveau est défini par le niveau symptomatique établi sur les quatre dernières semaines (voir texte).
CSI : corticostéroïdes inhalés ; BDLA : bronchodilatateurs de longue durée d’action ; ALT : antagoniste du récepteur aux leucotriènes ; B2 : β2-mimétiques de courte durée d’action.
Adapté de : GINA 2022, Report, Global Strategy for Asthma Management and Prevention.
1. Corticostéroïdes inhalés
Ils constituent, par leur action anti-inflammatoire, la base du traitement de fond.
Chez l’enfant d’âge scolaire, une corticothérapie inhalée est débutée lorsque l’asthme est symptomatique, c’est-à-dire partiellement ou non contrôlé sans traitement de fond.
Lorsque l’asthme est bien contrôlé, un traitement de fond peut néanmoins être commencé en présence de facteurs de risque de crises (voir tableau 57.4).
Chez l’enfant d’âge préscolaire, une corticothérapie inhalée au long cours doit être proposée en présence de critère(s) de non-contrôle (voir tableau 57.4) ou en cas d’antécédents d’au moins trois crises dans l’année précédente.
La dose minimale efficace doit toujours être recherchée. Celle-ci dépend de l’âge de l’enfant et de la molécule utilisée. Les doses faibles à modérées permettent d’obtenir un bon contrôle de l’asthme chez l’immense majorité des enfants. Lorsque le contrôle de l’asthme n’est pas obtenu avec des doses moyennes à élevées de CSI, une évaluation spécialisée est indispensable pour guider la stratégie thérapeutique.
Les effets secondaires locaux de la corticothérapie inhalée sont : la candidose (prévenue par le rinçage de la bouche après administration) et la dermite péri-orale.
Les effets secondaires systémiques sont plus rares, en particulier aux doses faibles et modérées, en raison de la faible absorption systémique des corticoïdes inhalés. Il s’agit principalement d’un ralentissement transitoire de la vitesse de croissance de la taille en début de traitement, dose-dépendant, avec rattrapage secondaire, et un risque de perte de taille d’environ 1 cm à l’âge adulte.
Ce potentiel passage systémique justifie néanmoins, une fois les manifestations d’asthme contrôlées, d’utiliser la dose minimale de corticoïdes inhalés efficace sur les plans clinique et fonctionnel respiratoire, et de surveiller la croissance staturale.
La corticothérapie par voie générale n’a pas sa place dans le traitement de fond de l’asthme de l’enfant.
À partir de l’âge de 12 ans, la stratégie « fond et demande », reposant sur l’association corticoïde inhalé-formotérol, peut être utilisée comme chez l’adulte. Elle est recommandée comme la stratégie préférentielle par le GINA 2022. Dans cette stratégie, l’association corticoïde inhalé-formotérol est utilisée à la fois en traitement de fond et en traitement de secours car le formotérol à un délai d’action court comparable à celui du salbutamol.
2. Autres traitements médicamenteux
Lorsqu’un contrôle optimal de l’asthme n’est pas obtenu avec une dose faible de corticoïdes inhalés, il est recommandé d’associer en première intention une autre classe médicamenteuse, plutôt que d’augmenter les doses de corticoïdes inhalés.
Les bronchodilatateurs à longue durée d’action (BDLA) sont préférés. Ce sont des médicaments inhalés, avec une AMM à partir de l’âge de 4 ans. Les principaux BLDA sont le salmétérol et le formotérol. Les associations combinant corticoïde inhalé et BDLA sont à privilégier en cas de prescription conjointe des deux molécules, afin de faciliter l’observance : fluticasone-salmétérol, budésonide-formotérol, fluticasone-formotérol.
Les antagonistes des récepteurs aux leucotriènes (ou antileucotriènes, ALT) peuvent être utilisés comme alternative aux BLDA. Les ALT sont disponibles sous forme orale. Seul le montélukast a l’AMM à partir de l’âge de 6 mois.
Les effets indésirables neuropsychiatriques liés aux ALT sont fréquents et imposent l’arrêt du traitement : cauchemars, troubles de l’attention, dépression.
Une biothérapie peut être prescrite après l’âge de 6 ans, en cas d’asthme sévère.
C. Modalités d’utilisation des traitements inhalés chez l’enfant
Les médicaments de l’asthme sont contenus dans des dispositifs de type aérosol-doseurs pressurisés ou inhalateurs de poudre sèche. Le choix de la méthode d’inhalation est fonction de la molécule, de l’âge et des préférences de l’enfant (fig. 57.3).
Les chambres d’inhalation avec masque facial sont adaptées aux enfants de la naissance à l’âge de 3 ou 4 ans. Avec ce type de chambre, le dépôt nasal des médicaments est important, le dépôt bronchique limité.
Les chambres d’inhalation avec embout buccal (fig. 57.4) sont généralement utilisables à partir de 3 ou 4 ans. Leur utilisation permet d’augmenter le dépôt bronchique du médicament.
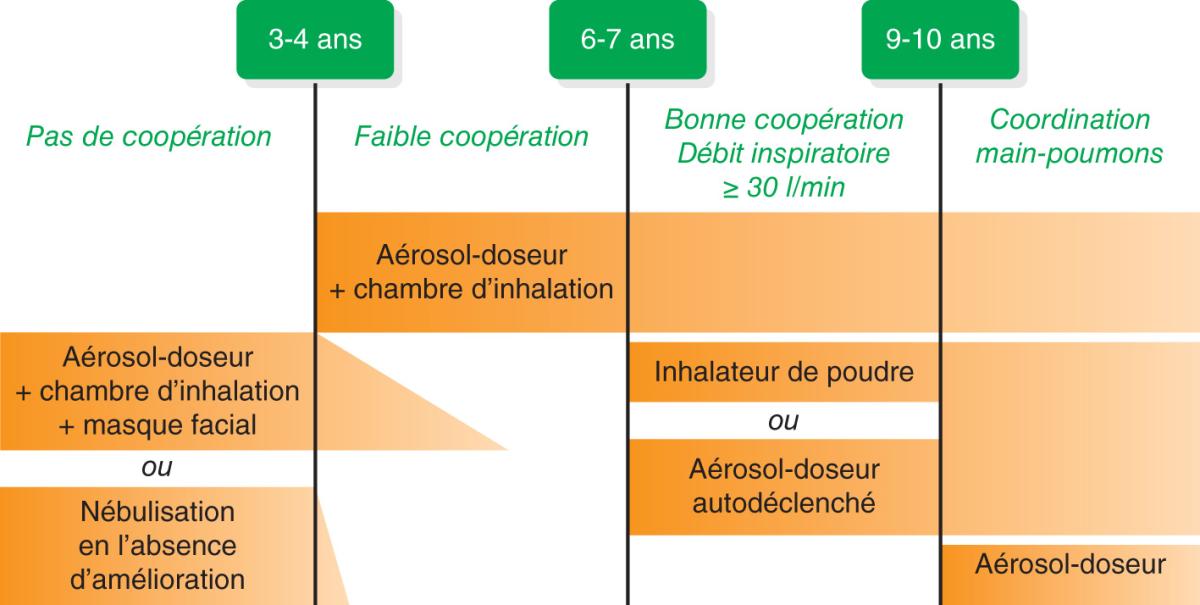
Fig. 57.3. ![]() Méthodes d’inhalation.
Méthodes d’inhalation.
Les inhalateurs de poudre sèche sont utilisables à partir de 6 ou 7 ans, après vérification que la technique d’inhalation soit maîtrisée par l’enfant ; certains enfants ne réaliseront bien cette technique qu’à 8 voire 10 ans.
Les nébulisations (aérosols) avec un générateur pneumatique sont seulement utilisées dans l’asthme sévère chez les enfants d’âge préscolaire.

Fig. 57.4. ![]() Technique d’inhalation : aérosol-doseur avec chambre d’inhalation sans masque facial.
Technique d’inhalation : aérosol-doseur avec chambre d’inhalation sans masque facial.
Source : Grégoire Benoist.
D. Contrôle de l’environnement et des comorbidités
1. Environnement
La persistance d’expositions à des allergènes ou à des polluants/irritants augmente le risque de crise d’asthme. L’environnement du patient doit donc être évalué et contrôlé au mieux.
Les éléments à analyser sont l’existence d’une exposition tabagique, la salubrité du logement (humidité, moisissures), la présence d’animaux domestiques, la présence de tapis, moquette, peluches, poussière (acariens).
Contrôler l’environnement est d’autant plus important qu’il existe un allergène responsable de symptômes (éviction de l’animal présent au domicile, mesures anti-acariens).
2. Comorbidités
Certaines comorbidités fréquemment associées à l’asthme doivent être recherchées et prises en charge car elles augmentent le risque de persistance et/ou la sévérité de l’asthme.
Les comorbidités allergiques sont : la rhinite allergique, l’allergie alimentaire IgE-médiée.
Les comorbidités non allergiques sont : l’obésité, la rhinosinusite, le reflux gastro-œsophagien, un syndrome d’hyperventilation, la dyskinésie des cordes vocales, un SAHOS.
La vaccination contre la grippe saisonnière est recommandée chez l’enfant asthmatique âgé de plus de 6 mois.
E. Modalités de surveillance
Le niveau de sévérité de l’asthme est évalué rétrospectivement à chaque consultation par le niveau de traitement médicamenteux nécessaire à l’obtention d’un bon contrôle.
Un asthme est qualifié de léger s’il est bien contrôlé au palier 1 ou au palier 2 de l’escalade thérapeutique (voir fig. 57.2). Il est qualifié de modéré s’il est bien contrôlé aux paliers 3 ou 4. Il est qualifié de sévère s’il nécessite un palier 5.
Une démarche systématique doit être respectée devant un asthme qui reste symptomatique : évaluation de l’observance et de la technique d’inhalation, contrôle de l’environnement et des comorbidités (fig. 57.5). Un avis spécialisé doit aussi être demandé en cas d’asthme sévère.
La fréquence des consultations est fonction de la sévérité de l’asthme et de son contrôle. Les consultations de suivi ont lieu environ tous les 3 à 6 mois, avec réalisation d’EFR (si en âge) au moins une fois par an.

Fig. 57.5. ![]() Stratégie en cas de symptômes ou exacerbations persistant malgré le traitement de fond.
Stratégie en cas de symptômes ou exacerbations persistant malgré le traitement de fond.
D’après : GINA 2022, Report, Global Strategy for Asthma Management and Prevention.
Objectifs des consultations de suivi :
- évaluer l’observance des traitements et la technique d’inhalation ;
- évaluer les symptômes (crise, contrôle) et la fonction respiratoire (EFR) et ainsi le niveau de sévérité de l’asthme ;
- évaluer le retentissement sur la qualité de vie ;
- optimiser la prise en charge de l’environnement et des comorbidités ;
- réaliser l’éducation thérapeutique (techniques inhalation, prise en charge des crises) ;
- adapter le traitement.
Objectifs de l’éducation thérapeutique de l’enfant asthmatique :
- la compréhension de la maladie ;
- l’identification des facteurs d’exacerbation ;
- la connaissance des moyens de prévention des crises ;
- la maîtrise des techniques d’inhalation ;
- la reconnaissance des signes requérant une consultation médicale urgente ;
- la prise de mesures adaptées d’autogestion d’une crise ;
- la connaissance et la bonne observance du traitement de fond.
Le plan d’action pour la gestion d’une crise d’asthme à domicile indique le traitement de secours à administrer en cas de symptômes, les doses d’une éventuelle corticothérapie orale, ainsi que les signes imposant un avis médical urgent.
La mise en place d’un projet d’accueil individualisé (PAI) est nécessaire pour organiser la gestion d’une crise d’asthme à l’école ou en collectivité.
Une prise en charge à 100 % peut être demandée pour les cas d’asthme les plus sévères.
Objectif du traitement de fond = « contrôle » de la maladie asthmatique : CSI à dose minimale efficace, BDLA autorisés seulement à partir de 4 ans.
Non-contrôle de l’asthme : vérifier l’observance thérapeutique et les techniques d’inhalation adaptées à l’âge de l’enfant, évoquer un diagnostic différentiel.
Mesures associées : contrôle de l’environnement et prise en charge des comorbidités, arrêt du tabagisme passif, vaccination antigrippale.
Suivi régulier : évaluation clinique et EFR, éducation thérapeutique de l’enfant et de son entourage, surveillance des effets secondaires des traitements.
Références
Société de pneumologie de langue française (SPLF) et Société pédiatrique de pneumologie et allergologie (SP2A). Mise à jour des recommandations (2021) pour la prise en charge et le suivi des patients asthmatiques adolescents (de 12 ans et plus). Rev Mal Resp 2022;39(2):179–87.

|
2022 GINA Report, Global Strategy for Asthma Management and Prevention. https://ginasthma.org/wp-content/uploads/2023/04/GINA-2022-Pocket-Guide… |
