Objectifs pédagogiques
- Diagnostiquer une hypoglycémie.
- Identifier les situations d’urgence et planifier leur prise en charge
Avant de commencer…
Un malaise, des troubles neurologiques (convulsions, hallucinations…) ou des signes adrénergiques aigus (pâleur, palpitations) peuvent conduire à suspecter le diagnostic d’hypoglycémie.
Les hypoglycémies en pédiatrie sont le plus souvent bénignes et banales, en particulier chez les enfants recevant certains traitements antidiabétiques.
Une enquête étiologique anamnestique doit être systématiquement réalisée, éventuellement complétée par des examens complémentaires. En effet, une hypoglycémie peut constituer le premier signe d’une pathologie rare et grave : une insuffisance surrénalienne ou un déficit de la β-oxydation des acides gras chez l’enfant, maladies pouvant parfois mettre en jeu dans l’urgence le pronostic vital ou neurologique.
Les causes d’hypoglycémies sont extrêmement variées et diffèrent selon l’âge : médicamenteuses, endocriniennes, génétiques (maladies héréditaires du métabolisme), toxiques, infectieuses, paranéoplasiques, auto-immunes et fonctionnelles. Des données simples anamnestiques (jeûne court/long, con-texte), cliniques (hépatomégalie, défaillance d’organe associée), biologiques (glycémie, lactacidémie, cétonurie, hormonologie, acylcarnitines) permettent de conduire à un diagnostic dans la majorité des cas.
I. Pour bien comprendre
A. Généralités
L’hypoglycémie se définit par un chiffre de glycémie < 0,50 g/l [2,8 mmol/l] au diagnostic.
Classiquement, la définition de l’hypoglycémie comprend la présence de symptômes cliniques associés à la glycémie basse, mais ce n’est pas toujours le cas.
La démarche étiologique diffère selon l’âge.
Chez l’enfant, l’hypoglycémie fonctionnelle prédomine par sa fréquence mais doit rester un diagnostic d’élimination. Les maladies génétiques ou hormonales sont possibles et potentiellement sévères.
Chez l’adulte, les causes les plus habituelles sont les toxiques (alcool, médicaments), les déficits hormonaux ; mais il faut évoquer aussi l’insulinome et les causes auto-immunes.
Dans trois situations particulières bien identifiées, le seuil d’hypoglycémie est différent et correspond à un objectif thérapeutique :
- < 0,70 g/l [3,9 mmol/l] chez le diabétique ;
- < 0,60 g/l [3,3 mmol/l] chez le sujet ayant une maladie chronique hypoglycémiante déjà diagnostiquée (hyperinsulinisme congénital, glycogénoses…) et chez le nouveau-né ayant une hypoglycémie symptomatique ;
- < 0,40 g/l [2,2 mmol/l] chez le nouveau-né ayant une hypoglycémie asymptomatique avant 48 heures de vie.
B. Rappels de physiopathologie
L’homéostasie glycémique se définit par un équilibre entre :
- des facteurs hyperglycémiants : les apports alimentaires, les hormones hyperglycémiantes (GH, glucagon, cortisol, catécholamines), le degré de résistance périphérique à l’insuline, l’efficacité des mécanismes hépatiques de production du glucose (glycogénolyse et néoglucogenèse) ;
- des facteurs hypoglycémiants : l’insuline, la consommation tissulaire en glucose (cerveau et reins avant tout).
Toute cause de dysfonctionnement de cet équilibre peut conduire à une hypoglycémie, qui est toujours pathologique.
Hypoglycémie (hors situations particulières) : glycémie < 0,50 g/l [2,8 mmol/l].
II. Diagnostiquer une hypoglycémie et planifier la prise en charge
A. Identifier une hypoglycémie
Une hypoglycémie peut se manifester par deux types de symptômes :
- des signes adrénergiques
- pâleur, hypothermie, sueurs et tachycardie, parfois tremblements ;
- ce sont les premiers signes à apparaître, ils reflètent une augmentation de la sécrétion de catécholamines en réponse à l’hypoglycémie ; chez un patient qui présente des hypoglycémies plusieurs fois par jour, ces symptômes n’apparaissent plus ;
- des signes neuroglucopéniques :
- fringale, signes neurologiques variés tels que convulsions, hallucinations, troubles de l’élocution, troubles visuels, troubles de la concentration, signes pyramidaux, dysesthésie, fatigue inhabituelle, malaise, somnolence, coma, hypothermie ;
- ils surviennent pour des glycémies plus basses et signent un déficit de substrat énergétique dans le SNC.
La classique triade de Whipple permet d’affirmer que les symptômes cliniques du patient étaient en rapport avec l’hypoglycémie ; elle associe :
- des signes neuroglucopéniques ;
- au moment d’une hypoglycémie ;
- avec correction de ces signes cliniques après normalisation de la glycémie.
B. Mesures urgentes
Un coma hypoglycémique est une urgence thérapeutique. Devant un coma d’apparition aiguë, aucun symptôme n’est spécifique de l’hypoglycémie : elle doit donc être recherchée de manière systématique, de même que sa cause (hypoglycémie par cause médicamenteuse ? infectieuse ?, etc.).
Le coma ou les convulsions liées à une hypoglycémie traduisent en effet une souffrance cérébrale. En cas d’hypoglycémie profonde durable, en particulier si l’hypoglycémie est sans cétose, et notamment en période néonatale, le risque de séquelles cérébrales est élevé. Le patient doit donc recevoir immédiatement un traitement visant à normaliser sa glycémie.
Patient inconscient :
- bolus de glucosé IV (à répéter toutes les 5 minutes jusqu’à normalisation de la glycémie) :
- chez le nouveau-né et le nourrisson : sérum G10 % 2 ml/kg ;
- chez l’enfant : sérum G30 % 10 ml/20 kg de poids ou G10 % 30 ml/20 kg de poids ;
- chez l’adolescent et l’adulte : sérum G30 % 20 à 30 ml ;
- glucagon à envisager si voie d’abord impossible, patient en PLS :
- voie IM ou SC, forme par voie nasale disponible à partir de 4 ans ;
- attention : efficace uniquement si la cause est liée à l’insuline (hyperinsulinisme con-génital, diabète connu) mesure de 1re intention au domicile par la famille ; contre-indiqué dans les situations d’hypoglycémie de jeune long de cause inconnue ;
- bilan sanguin après resucrage, mais au plus près de l’hypoglycémie (identique au prélèvement percritique, sauf qu’insuline et peptide C ne seront pas interprétables).
Patient conscient :
- bilan sanguin percritique (voir infra) avant resucrage ;
- glucose par voie orale (et/ou IV) :
- chez le nouveau-né et le nourrisson : sérum G10 % 2 ml/kg ;
- chez l’enfant : sucre 5 g/20 kg de poids ;
- chez l’adolescent (et adulte) : 15 g de sucre.
1 sucre en morceau = 5 g de sucre = 50 ml de jus d’orange ou de pomme = 50 ml de Cola = 50 ml de sérum glucosé G10 %.
Après normalisation de la glycémie par le resucrage, il est indispensable d’assurer des apports en glucides pour éviter une récidive immédiate d’hypoglycémie. Selon l’état du patient, il faut proposer : une collation comprenant un sucre lent, ou une perfusion de sérum glucosé à 10 %, en relais du resucrage aigu.
Une glycémie capillaire doit être pratiquée en urgence devant tout signe évocateur d’hypoglycémie, et plus généralement, devant tout trouble neurologique brutal et inexpliqué, notamment en cas de convulsion non fébrile chez l’enfant.
La correction d’une hypoglycémie constitue une urgence thérapeutique.
L’enquête paraclinique doit être faite au plus proche de l’hypoglycémie, idéalement avant resucrage sauf si urgence vitale ou enfant inconscient.
C. Enquête étiologique
1. Enquête clinique minutieuse
Les circonstances de survenue de l’hypoglycémie doivent être recueillies :
- âge du patient (nouveau-né, enfant, adulte) ;
- caractéristiques de l’hypoglycémie : au jeûne court ou long, épisode unique ou récidive, symptômes d’hypoglycémie et symptômes concomitants, sévérité des symptômes ;
- antécédents particuliers : chirurgie œsogastroduodénale, traitement médicamenteux, maladie chronique à risque d’hypoglycémie…
L’anamnèse doit écarter les situations pathologiques sévères conduisant de manière non spécifique à une hypoglycémie, résultant :
- d’une carence en glycogène ou en substrat pour la néoglucogenèse : dénutrition sévère, in-suffisance hépatique profonde aiguë ou chronique, jeûne très prolongé chez un enfant ;
- d’une augmentation de la consommation de glucose par les tissus, ou une augmentation de leur sensibilité à l’insuline : certaines tumeurs, sepsis sévère, certaines causes médicamenteuses ;
- d’une fuite urinaire de glucose : tubulopathie ;
- ou encore d’une intoxication alcoolique ou la prise de médicaments hypoglycémiants (par exemple, insuline, sulfamides, glinides, quinine, bêtabloquants).
L’examen clinique doit être complet, au premier rang duquel un examen neurologique rigoureux incluant la mesure du périmètre crânien ainsi que la recherche d’une hépatomégalie (parfois molle et très volumineuse comme dans les glycogénoses, donc difficile à mettre en évidence).
Si les hypoglycémies sont une situation banale et bénigne le plus souvent, l’objectif de l’enquête étiologique est de dépister les situations particulières où l’hypoglycémie serait le symptôme d’appel d’une pathologie aiguë ou chronique sévère.
Chez l’enfant âgé de moins de 10 ans, le diagnostic d’hypoglycémie fonctionnelle (= « hypoglycémie hypercétotique idiopathique de l’enfant ») est fréquent, bénin, et n’est évoqué que pour des jeûnes très prolongés. Cependant, ce diagnostic ne peut être posé que par exclusion des autres causes.
L’hypoglycémie fonctionnelle associe :
- jeûne très prolongé ;
- hypoglycémie peu profonde (> 0,40 g/l) ;
- hypoglycémie peu symptomatique ;
- forte cétose ;
- caractère non récurrent (ou très rarement) ;
- en l’absence d’élément suspect de maladie sous-jacente.
Certaines hypoglycémies ont des caractéristiques qui les rendent suspectes d’être le signe d’appel d’une maladie sous-jacente. Les hypoglycémies suspectes nécessitent d’être explorées et justifient un avis spécialisé.
Ces hypoglycémies sont considérées comme suspectes quand elles sont :
- inattendues : hypoglycémies pour un jeûne court ou pas assez long pour l’âge (< 6 heures à la naissance, < 12 heures entre 1 et 5 ans, < 24 heures entre 5 et 10 ans ; après 10 ans, il ne devrait plus y avoir d’hypoglycémie de jeûne) ;
- ou récurrentes ;
- ou inappropriées : hypoglycémies très symptomatiques ou très profondes ; insuffisance voire absence de cétose ;
- ou accompagnées de signes associés : hépatomégalie, défaillance d’organe aiguë ou chronique, acidose sévère avec pH < 7,10, mélanodermie, croissance pondérale ou staturale anormale, malformation (pouvant orienter vers un syndrome génétique chez un enfant)…
Enfin, l’hypoglycémie peut survenir chez un patient connu pour être porteur d’une maladie hypoglycémiante ou recevant un traitement hypoglycémiant, auquel cas la cause de l’hypoglycémie est d’emblée connue :
- maladie acquise : insuffisance hépatocellulaire, septicémie, diabète traité… ;
- maladie génétique : glycogénose, hyperinsulinisme congénital… ;
- traitement hypoglycémiant ; insuline dans le diabète de type 1 ou de type 2, analogues du GLP-1 ou metformine dans le diabète de type 2 de l’adolescent.
2. Enquête paraclinique
Bilan de première intention
Toute hypoglycémie doit être authentifiée par une glycémie veineuse, cette confirmation ne devant pas retarder la prise en charge thérapeutique.
L’enquête paraclinique est systématique en cas d’hypoglycémie suspecte, et prélevée avant resu-crage. En cas de situation d’urgence vitale et/ou de patient inconscient, l’urgence est de traiter l’hypoglycémie.
Patient conscient = bilan sanguin percritique au moment même de l’hypoglycémie :
- glycémie veineuse sur tube avec inhibiteur de la glucosidase ;
- insuline, peptide C (uniquement interprétables en hypoglycémie) ;
- GH, cortisol, ACTH ;
- lactate ;
- ionogramme sanguin, réserve alcaline ;
- cétonémie ;
- profil des acylcarnitines plasmatiques ou sanguines ;
- (et idéalement 3OH-butyrate et acides gras libres) ;
- recueil de la première miction suivant l’hypoglycémie : cétonurie à la bandelette.
Si le bilan percritique n’a pas été réalisé, deux pathologies doivent être tout de même systéma-tiquement écartées au décours de l’épisode d’hypoglycémie (en raison du risque de séquelle en l’absence de traitement) par :
- dosage le matin à jeun de la cortisolémie et de l’ACTH plasmatique : insuffisance surrénale ;
- dosage du profil des acylcarnitines plasmatiques : déficits de la β-oxydation des acides gras.
Patient inconscient = bilan sanguin au plus près de l’hypoglycémie :
- identique au prélèvement percritique précité ;
- attention : insuline et peptide C ne seront pas interprétables (ils ne le sont qu’en situation d’hypoglycémie).
Bilan de deuxième intention
Les hypoglycémies suspectes de maladies sous-jacentes nécessitent de garder l’enfant en hospita-lisation pour poursuivre des explorations adaptées à l’histoire clinique et aux résultats du bilan percritique, en lien avec un service spécialisé.
3. Orientation diagnostique (fig. 8.1)
L’enquête clinique permet souvent d’avoir une orientation diagnostique éclairée.
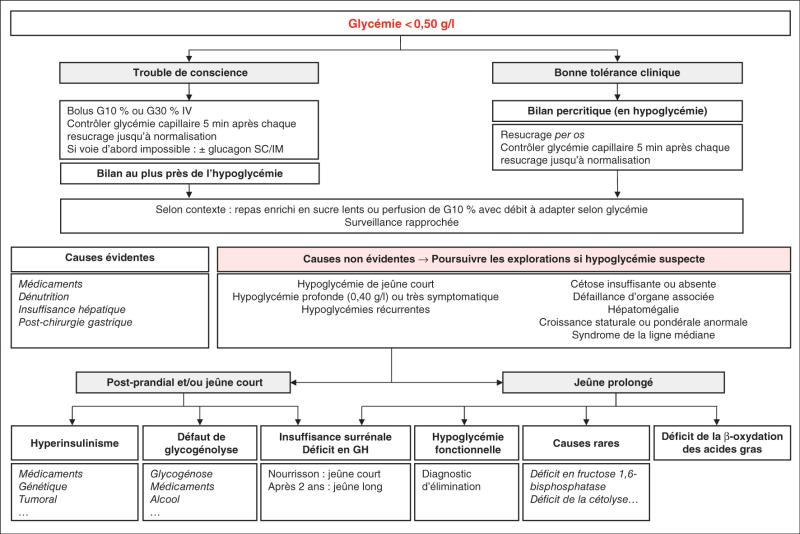
Fig. 8.1. ![]() Arbre diagnostique devant une hypoglycémie chez l’enfant (hors nouveau-né et diabète connu).
Arbre diagnostique devant une hypoglycémie chez l’enfant (hors nouveau-né et diabète connu).
D’après : Arnoux J.-B. Pas à pas en pédiatrie. Arbres décisionnels commentés des Sociétés de pédiatrie. © 2019 Elsevier Masson SAS. Tous droits réservés.
Souvent, la cause de l’hypoglycémie sera évidente par l’anamnèse et le contexte : cause médica-menteuse (diabètes traités par insuline ou antidiabétiques oraux, par exemple), diabète gesta-tionnel mal équilibré pour un nouveau-né, dénutrition, septicémie…
Cependant, des situations pathologiques sévères conduisant de manière non spécifique à une hy-poglycémie doivent être identifiées (voir supra). Une défaillance multiviscérale oriente vers une insuffisance surrénale ou un déficit de la β-oxydation des acides gras.
Hypoglycémies au jeûne court
Les hypoglycémies au jeûne court ou à l’état nourri doivent particulièrement évoquer un mécanisme lié à l’insuline (forme génétique d’hyperinsulinisme ou fonctionnelle après chirurgie œsogastrique ou duodénale, ou un insulinome) ou bien une glycogénose, ou une intoxication alcoolique ou médicamenteuse, ou un panhypopituitarisme avec déficit en GH et cortisol chez un nouveau-né ou un nourrisson – chez les enfants plus âgés, le panhypopituitarisme provoque des hypoglycémies de jeûne long.
Une réponse exagérée au test au glucagon (augmentation de glycémie > 0,30 g/l dans les 30 minutes après l’injection de glucagon en hypoglycémie) oriente principalement vers un mécanisme d’hypoglycémie impliquant l’insuline. Une réponse négative au test au glucagon oriente vers une glycogénose.
Le diagnostic peut également être orienté par la quantité de glucose nécessaire pour corriger l’hypoglycémie : si la correction de l’hypoglycémie nécessite des apports supraphysiologiques en glucose, le mécanisme en cause implique obligatoirement un hyperinsulinisme.
Hypoglycémie au jeûne long
Les hypoglycémies au jeûne long chez l’enfant peuvent révéler un déficit hormonal, un défaut de la néoglucogenèse ou un déficit de la β-oxydation des acides gras.
Une cétose doit toujours être recherchée : l’absence de cétose au jeûne long est anormale et oriente vers un déficit de la β-oxydation des acides gras (habituellement tableau aigu avec myolyse et/ou insuffisance hépatique chez un enfant).
Éléments d’orientation : jeûne court/long, défaillance d’organe associée, hépatomégalie, cétose.
Connaître les caractéristiques d’hypoglycémie fonctionnelle et d’hypoglycémie suspecte.
Références
Cryer PE, Axelrod L, Grossman AB, et al. Evaluation and management of adult hypoglycemic disorders: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2009;94:709–28.

|
Arnoux J.-B. Hypoglycémie de l’enfant (hors nouveau-né et diabètes). Pas à pas en pédiatrie. Arbres décisionnels commentés des Sociétés de pédiatrie. 2019. https://pap-pediatrie.fr/files/09_hypoglycemie_de_lenfant_hors_nouveau-… |
