Items, objectifs pédagogiques
Item 32 – Évaluation et soins du nouveau-né à terme
- Réaliser un examen complet du nouveau-né à terme.
- Reconnaître les situations nécessitant une prise en charge spécialisée.
- Reconnaître et diagnostiquer une infection pendant le premier mois de vie.
- Promouvoir la qualité des premiers liens affectifs parents-enfant.
- Expliquer aux parents les bases de la puériculture et les informer des mesures de prévention à mettre en œuvre dans les deux premières années de la vie.
Item 30 – Prématurité et retard de croissance intra-utérin : facteurs de risque et prévention
- Expliquer les principaux facteurs de risque et les éléments de prévention.
- Décrire les principales complications et les principaux facteurs pronostiques.
Item 27 – Prévention des risques fœtaux : infection, médicaments, toxiques, irradiation
- Expliquer les éléments de prévention vis-à-vis des infections à risque fœtal.
Item 33 – Allaitement maternel
- Expliquer les modalités et argumenter les spécificités de l’allaitement maternel.
- Préciser les complications éventuelles et leur prévention.
Item 169 – Infections à VIH
- Dépister une infection à VIH au cours de la grossesse et en organiser la prise en charge.
Item 255 – Diabète gestationnel
- Dépister et prendre en charge le diabète gestationnel.
Avant de commencer…
Le nouveau-né est un enfant âgé de moins de 28 jours.
La naissance est marquée par le passage de la vie intra-utérine à la vie aérienne, et d’un état de dépendance totale à l’autonomie. Cette transition met en jeu des phénomènes d’adaptation, rapides et vitaux pour la respiration et la circulation, plus progressifs pour d’autres fonctions.
Objectifs principaux de la prise en charge du nouveau-né :
- prévenir des risques spécifiques par l’anamnèse obstétricale ;
- vérifier la qualité de l’adaptation à la vie extra-utérine et s’assurer de la normalité des grandes fonctions physiologiques ;
- apprécier la maturité et la trophicité ;
- dépister d’éventuelles anomalies ou malformations congénitales ;
- repérer des facteurs de risque individuels ;
- diagnostiquer et traiter les pathologies de la période néonatale précoce ;
- s’assurer du développement d’une relation mère-enfant satisfaisante ;
- donner des conseils de puériculture appropriés et répondre aux questions des parents.
I. Évaluation clinique du nouveau-né à terme
A. Prise en charge en salle de naissance
1. Généralités
L’anticipation de toute situation susceptible d’être à risque immédiat est la règle.
Le dossier obstétrical comporte des données indispensables : les antécédents familiaux et particulièrement ceux de la mère (gynéco-obstétricaux et médicaux, notamment affections chroniques susceptibles de retentir sur la santé de l’enfant, sérologies, groupe sanguin), le suivi de la grossesse, les échographies, le terme (= âge gestationnel), les éventuelles anomalies dépistées par un diagnostic anténatal, l’état clinique de la mère (dont signes d’infection) et le monitoring cardiaque fœtal durant l’accouchement.
Chaque naissance nécessite la présence d’au moins une personne entraînée (sage-femme ou pédiatre) aux premiers gestes de prise en charge, et s’occupant uniquement de ce nouveau-né (une personne par enfant en cas de naissances multiples).
Un examen clinique précoce, appareil par appareil, est effectué systématiquement. Il a pour objectif d’apprécier non seulement la qualité de l’adaptation à la vie extra-utérine, mais aussi d’éliminer une anomalie morphologique, nécessitant une prise en charge rapide.
2. Évaluation de l’adaptation à la vie extra-utérine
Le score d’Apgar (tableau 44.1) est établi à 1, 5 et 10 minutes de vie.
La cotation de ce score comprend cinq paramètres chiffrés de 0 à 2, permettant d’évaluer la qua-lité de l’adaptation du nouveau-né à la vie extra-utérine : fréquence cardiaque (pouls au cordon), mouvements respiratoires, réactivité, tonus musculaire, coloration. Le nouveau-né normal a un score d’Apgar ≥ 7.
Tableau 44.1. ![]() Score d’Apgar.
Score d’Apgar.
| Paramètres | 0 | 1 | 2 |
|---|---|---|---|
| Battements cardiaques | Absents | < 100/min | ≥ 100/min |
| Mouvements respiratoires | Absents | Lents, irréguliers | Vigoureux, avec cris |
| Tonus musculaire | Nul | Faible (légère flexion des extrémités) | Fort (quadriflexion, mouvements actifs) |
| Coloration | Globalement bleue ou pâle | Corps rose Extrémités bleues |
Globalement rose |
| Réactivité à la stimulation | Nulle | Faible (grimace) | Vive (cris, toux) |
En cas de difficultés d’adaptation à la vie extra-utérine (mouvements respiratoires inefficaces ou absents, bradycardie), l’enfant nécessite des manœuvres de réanimation (fig. 44.1). Cette situation concerne 6 à 10 % des nouveau-nés.
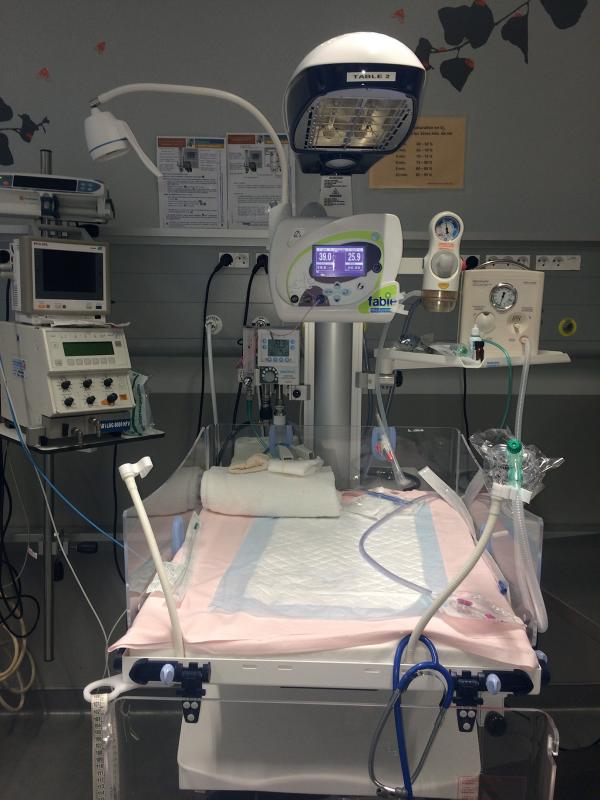
Fig. 44.1. ![]() Salle de naissance : matériel.
Salle de naissance : matériel.
Source : Elsa Kermorvant.
3. Soins initiaux au nouveau né
Certains gestes sont systématiques (tableau 44.2).
Tableau 44.2. ![]() Soins systématiques en salle de naissance du nouveau-né à terme bien portant.
Soins systématiques en salle de naissance du nouveau-né à terme bien portant.
| Dans un premier temps, à la naissance de l’enfant |
| – Clampage et section du cordon (après les premiers cris si l’enfant est vigoureux) – Séchage soigneux, bonnet (prévention de l’hypothermie) – Évaluation de la vitalité de l’enfant (score d’Apgar à 1, 5 et 10 minutes) – Placement sur le ventre de la mère en peau à peau (si l’état de l’enfant et celui de la mère le permettent) – Mise au sein dans la première heure de vie si la mère souhaite allaiter |
| Dans un deuxième temps, mais avant le départ de la salle de naissance pour les suites de couches |
| – Examen clinique initial, qui sera répété au cours du séjour en maternité – Mesure des paramètres de naissance (TN, PN, PCN) et consignation dans le carnet de santé – Soins du cordon et vérification de la présence de deux artères et une veine ombilicales – Désinfection oculaire par collyre antibiotique si antécédent et/ou facteur de risque d’IST chez les parents – Administration de vitamine K1 per os – Mise en place de bracelets d’identification |
La prévention de l’hypothermie est essentielle.
L’enfant doit naître dans une atmosphère chaude (≈ 24 °C), et bénéficier d’un séchage soigneux avec un linge propre stérile. Le nouveau-né normal est ensuite placé en peau à peau sur la poitrine de sa mère (avec surveillance) ; si son état nécessite des soins urgents, il est placé sur une table radiante (fig. 44.1).
Les soins du cordon ombilical consistent en la pose d’un clamp, la section avec ciseaux stériles et désinfection de la zone de section, la vérification de la présence de deux artères et d’une veine ombilicales (fig. 44.2), puis éventuellement la protection par une compresse stérile.
D’autres gestes dépendent du contexte anamnestique ou clinique.
Une antibioprophylaxie conjonctivale est recommandée, en cas d’antécédents et/ou de facteurs de risque d’IST (grossesse non ou mal suivie) chez les parents.
La recherche d’une atrésie des choanes par une sonde d’aspiration n’est effectuée qu’en présence d’une dyspnée inspiratoire et/ou d’une désaturation qui se lève aux cris.
Le test à la seringue, qui consiste à injecter rapidement de l’air dans une sonde orogastrique à la recherche d’un bruit aérique au niveau du creux épigastrique et qui permet d’éliminer une atrésie de l’œsophage, est effectué sur signes d’appel : hydramnios ou malformation congénitale diagnostiqués en anténatal, hypersialorrhée, gêne respiratoire.
La perméabilité anale est vérifiée par l’inspection et l’émission de méconium dans un délai normal (≤ 48 heures).
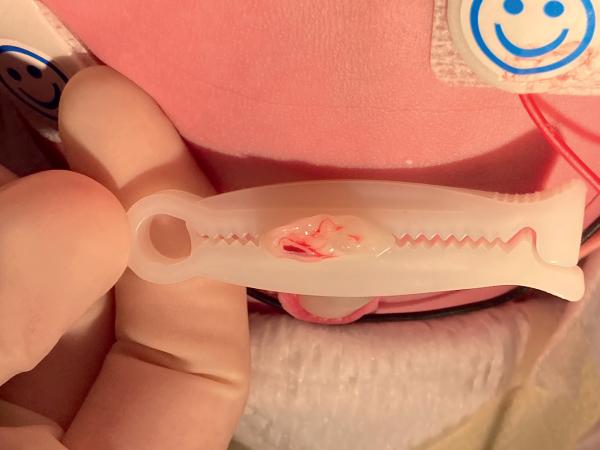
Fig. 44.2. ![]() Cordon ombilical avec présence de deux artères et d’une veine ombilicales.
Cordon ombilical avec présence de deux artères et d’une veine ombilicales.
Source : Elsa Kermorvant.
Soins systématiques du nouveau-né : retenir le tableau 44.2.
Mauvaise adaptation à la vie extra-utérine : nécessité de manœuvres de réanimation.
B. Examen clinique du nouveau-né
1. Généralités
Tout nouveau-né bénéficie d’un examen clinique complet en salle de naissance avant son transfert dans le service des suites de couches avec sa mère.
Au moins un autre examen complet est effectué pendant le séjour à la maternité. Obligatoire avant le 8e jour de vie, ce dernier est consigné dans le carnet de santé et permet d’établir le premier certificat de santé (certificat du 8e jour).
Il est effectué en présence de la mère ou des deux parents, dans une pièce claire, suffisamment chauffée, avant un repas de préférence ou au moment d’un soin, lorsque l’enfant est bien éveillé, et en respectant les règles d’hygiène.
2. Aspect général
La température axillaire doit être prise à chaque examen. La définition de la fièvre est la même que chez tout enfant, soit une température ≥ 38 °C. Une fièvre à cet âge est une urgence diagnostique, et nécessite de débuter une antibiothérapie probabiliste (voir infra).
Les mensurations de naissance – poids, taille et périmètre crânien (PC) – sont essentielles à prendre et à reporter sur les courbes de croissance pour déterminer la trophicité, en les comparant aux courbes de croissance de référence pour la population ou à des courbes personnalisées prenant en compte la parité, le poids et la taille de la mère (courbes AUDIPOG en France).
Un nouveau-né à terme pèse en moyenne 3 500 g, a une taille de 50 cm et un PC de 35 cm. On considère comme normaux les poids compris entre 2 500 et 4 200 g, et les tailles comprises entre 46 et 52 cm.
L’inspection de l’enfant est très informative.
La coloration est un excellent reflet du fonctionnement des appareils cardiovasculaire et respiratoire. La peau du nouveau-né est généralement rose vif voire érythrosique, à l’exception des extrémités qui peuvent garder un aspect cyanique dans les heures qui suivent la naissance (acrocyanose, fig. 44.3).
Au repos, l’enfant est en flexion des quatre membres (fig. 44.4). La gesticulation spontanée est symétrique, les mouvements sont harmonieux. Le cri est clair et vigoureux. Le nouveau-né normal est vigilant, actif, tonique, capable d’interactions visuelles et auditives.
Un syndrome dysmorphique peut être constaté ; des anomalies échographiques anténatales ont pu être révélatrices (par exemple, trisomie 21).
Fig. 44.3. ![]() Acrocyanose des extrémités chez un nouveau-né.
Acrocyanose des extrémités chez un nouveau-né.
Source : Elsa Kermorvant.
Fig. 44.4. ![]() Nouveau-né en flexion des quatre membres.
Nouveau-né en flexion des quatre membres.
Source : Elsa Kermorvant.
3. Examen cardiovasculaire
La fréquence cardiaque à l’éveil et au repos (en l’absence de pleurs) varie entre 120 et 160 par minute.
Le temps de recoloration cutanée (évalué au niveau du thorax) doit être strictement inférieur à 3 secondes.
La palpation des pouls, notamment fémoraux, doit être systématique. La perception plus faible voire l’absence des pouls fémoraux doit faire chercher une coarctation de l’aorte.
L’audition d’un souffle cardiaque systolique dans les 2 premiers jours de vie n’est pas rare. Elle nécessite une échographie cardiaque et une surveillance spécifique (voir chapitre 65).
L’auscultation du crâne, au niveau de la fontanelle antérieure, recherche un souffle vasculaire qui doit faire évoquer une malformation artérioveineuse.
4. Examen pulmonaire
Une hypertrophie mammaire (avec éventuellement une sécrétion lactée) n’est pas pathologique (crise génitale liée à l’imprégnation hormonale passive in utero).
L’abdomen est souple, souvent un peu météorisé.
Le foie est souvent palpable et peut dépasser le rebord costal de 1 à 2 cm. Le pôle inférieur de la rate et les reins peuvent être parfois perçus.
Un diastasis des muscles droits est banal. La présence d’une hernie ombilicale ne justifie aucun traitement, la fermeture de l’anneau s’effectuant spontanément avant l’âge de 2 ans.
On doit noter l’absence de globe vésical, l’heure de la première miction, et la qualité du jet urinaire chez le garçon (une miction en goutte à goutte évoque une malformation urétrale). Les premières urines sont normalement émises avant 24 heures de vie.
Le méconium (fig. 44.5) correspond aux premières selles du nouveau-né. Épais et collant, de couleur noirâtre, il est normalement émis avant 48 heures de vie. La marge anale (aspect, position de l’anus) doit être soigneusement examinée pour éliminer une malformation anorectale. En cas de doute, ou de retard à l’émission du méconium, le passage d’une sonde permet de vérifier la perméabilité de l’anus.
Le cordon ombilical comprend deux artères et une veine.
La chute du cordon ombilical intervient dans un délai variable, en moyenne vers le 10e jour. Une chute retardée (au-delà de 1 mois de vie) doit faire rechercher un déficit immunitaire.
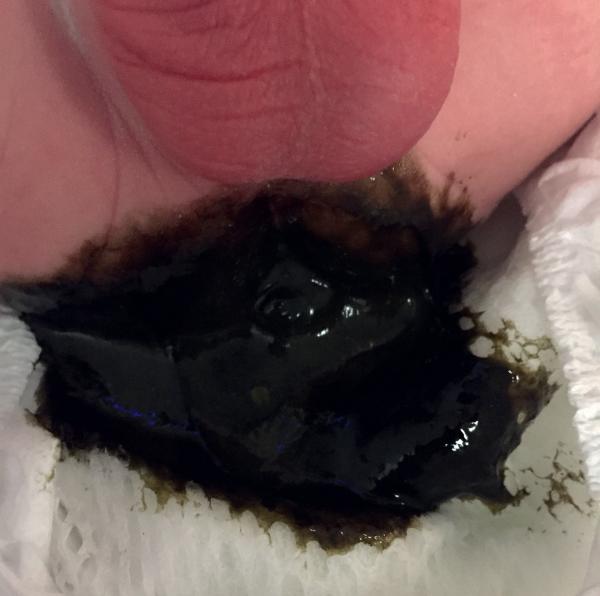
Fig. 44.5. ![]() Méconium.
Méconium.
Source : Grégoire Benoist
6. Examen des organes génitaux externes
Un examen attentif vérifie l’absence d’anomalie des organes génitaux (on parle alors de variation du développement des organes génitaux ; le terme d’ambiguïté sexuelle est à proscrire). Toute anomalie doit être reconnue et prise en charge dès les premières heures de vie, afin de ne pas déclarer de façon erronée un sexe déterminé ni méconnaître une hyperplasie congénitale des surrénales susceptible de mettre la vie de l’enfant en danger (voir chapitre 6).
Chez le garçon, le prépuce est rarement rétractable dans les premières années de vie. Le décalottage ne doit pas être forcé en raison du risque de paraphimosis et phimosis cicatriciel (voir chapitre 22).
La conduite à tenir en cas de testicule non descendu est précisée dans le chapitre 22.
Une hydrocèle (tuméfaction scrotale transilluminable) est fréquente. La régression spontanée est observée dans la majorité des cas (voir chapitre 22).
Chez la fille, l’inspection vérifie la présence de l’orifice vaginal. Leucorrhées et métrorragies sont possibles (crise génitale).
7. Examen cutané
La peau du nouveau-né à terme est rose voire érythrosique. Elle est recouverte dans les premières heures de vie du vernix caseosa, enduit blanc graisseux et adhérent, visible surtout dans les plis (fig. 44.6A). Une desquamation modérée est possible au cours des premiers jours, notamment chez les nouveau-nés post-termes.
Un ictère doit être recherché (voir chapitre 45).
Des particularités sémiologiques non pathologiques, transitoires, sont à connaître.
Des œdèmes peuvent être observés à la naissance au niveau des paupières, du dos des mains et des pieds et du pubis ou du scrotum. Ils régressent en quelques jours.
Le lanugo est un fin duvet, présent au niveau du front, du dos et des épaules (fig. 44.6B). Il disparaît en quelques jours. Les grains de milium sont des microkystes sébacés punctiformes blancs, siégeant sur le nez et la face (fig. 44.6C). L’érythème dit toxique est une éruption maculopapuleuse voire pustuleuse transitoire survenant le plus souvent entre H12 et J4.
Un livedo (aspect marbré par immaturité de la vasorégulation périphérique) peut être visible au niveau des membres et du thorax. La tache ethnique dite mongoloïde est un placard bleu ardoisé siégeant dans la région lombosacrée (voir fig. 44.10). Fréquente dans les populations originaires d’Asie et du pourtour méditerranéen, elle s’atténue en général dans les premières années de vie.
Un ou plusieurs angiomes plans de la glabelle, des paupières, du nez et de la nuque peuvent être observés (fig. 44.6D). Ils s’atténuent en quelques mois, sauf celui de la nuque qui peut persister jusqu’à l’âge adulte.
Ils sont à distinguer d’un hémangiome, apparaissant après quelques jours de vie. Il peut se présenter en relief et de coloration rouge vif (fig. 44.7) ou être de type dermique profond.
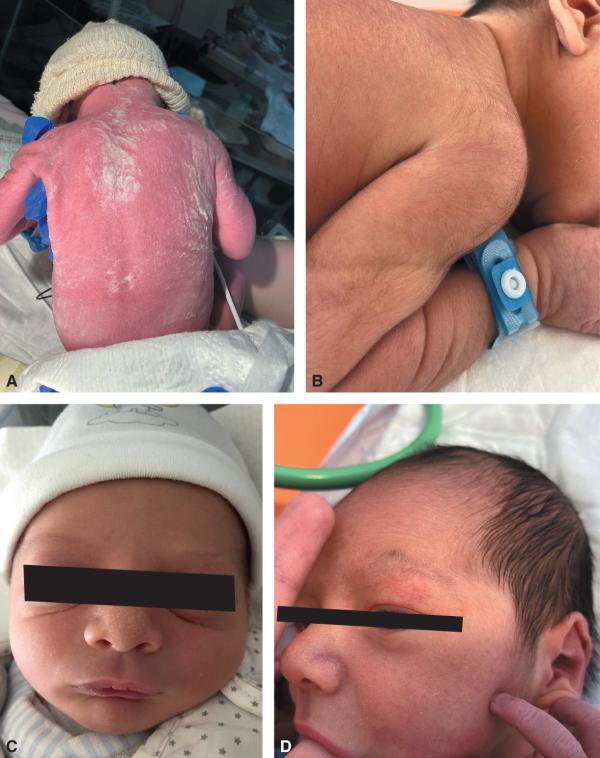
Fig. 44.6. ![]() A. Vernix caseosa. B. Lanugo. C. Grains de milium. D. Angiome plan de la paupière.
A. Vernix caseosa. B. Lanugo. C. Grains de milium. D. Angiome plan de la paupière.
Source : Elsa Kermorvant (44.6 A, B et D), Grégoire Benoist (44.6C).
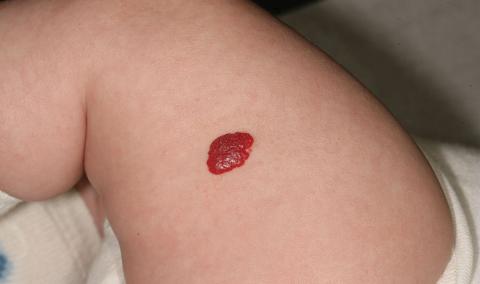
Fig. 44.7. ![]() Hémangiome tubéreux.
Hémangiome tubéreux.
8. Examen de la tête et de la face
Les fontanelles ont des tailles variables. Elles sont normalement souples, ni déprimées ni bombées. La fontanelle antérieure a une forme losangique et se ferme entre les âges de 8 mois et 18 mois ; la fontanelle postérieure est palpable dans les 2 ou 3 premières semaines de vie. Les sutures sont normalement bord à bord, mobiles, mais elles peuvent se chevaucher dans les premiers jours de vie (fig. 44.8).
Une bosse sérosanguine est souvent observée. Il s’agit d’une collection sous-cutanée, molle, mal limitée, chevauchant les sutures et se résorbant en 2 à 6 jours. Le céphalhématome, plus rare, est une collection sous-périostée, limitée par les sutures, pouvant évoluer vers la calcification en 4 à 6 semaines.
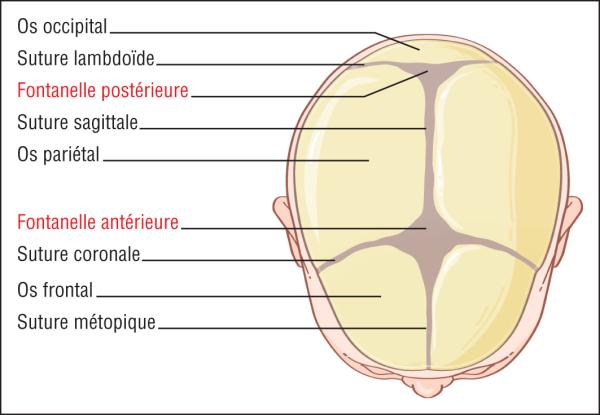
Fig. 44.8. ![]() Crâne du nouveau-né : fontanelles et sutures.
Crâne du nouveau-né : fontanelles et sutures.
Illustration de Carole Fumat.
L’examen du cou doit apprécier ses mobilités passive et active. La constatation d’un torticolis doit faire préciser son caractère réductible ou non. La palpation des muscles sternocléidomastoïdiens permet de mettre en évidence un éventuel hématome. L’examen du cou recherche aussi une masse anormale ou un orifice cutané.
L’examen de la bouche permet de dépister une fente (vélo-)palatine (fig. 44.9) ou une brièveté du frein de langue. L’intégrité du palais est vérifiée à la palpation (petit doigt).
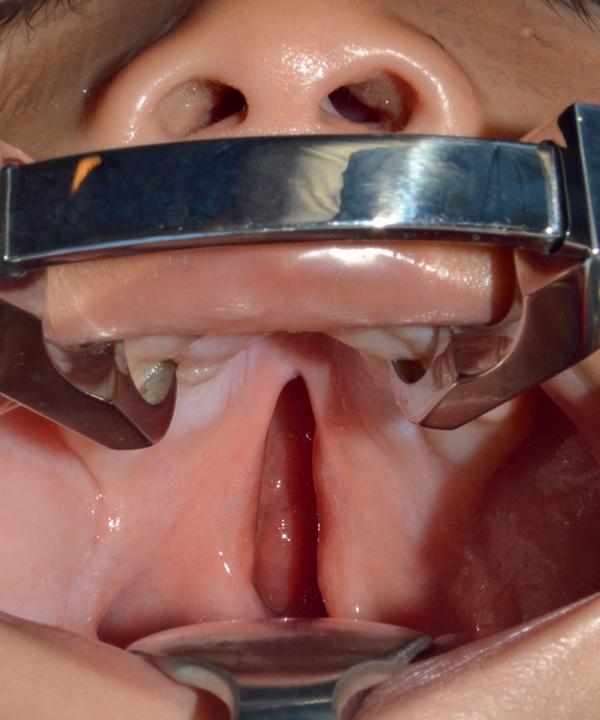
Fig. 44.9. ![]() Fente isolée et incomplète du palais secondaire (ou fente palato-vélaire subtotale).
Fente isolée et incomplète du palais secondaire (ou fente palato-vélaire subtotale).
Le voile est fendu en totalité avec deux hémi-luettes. Le palais osseux n’est pas atteint en totalité, c’est-à-dire que la fente ne s’étend pas jusqu’à la gencive en avant.
Source : Pierre Corre.
L’examen des yeux vérifie l’aspect des conjonctives, des iris et des pupilles, ainsi que la symétrie des reflets cornéens. Un strabisme (asymétrie des reflets) modéré et intermittent peut être observé ; sa persistance au-delà de l’âge de 3 mois doit conduire à un examen ophtalmologique (voir chapitre 4). L’examen, à l’aide d’un ophtalmoscope, vérifie aussi la présence des lueurs pupillaires, témoignant de l’absence de cataracte congénitale.
9. Examen neurosensoriel
L’examen neurologique (tonus passif et actif, automatismes primaires) permet de vérifier les compétences motrices, témoins de l’intégrité du système nerveux, et les capacités neurosensorielles du nouveau-né. Il est influencé par l’âge gestationnel, dont il est un critère de maturation (détails infra).
Le comportement global d’un nouveau-né est caractérisé par un éveil calme facile à obtenir, une réactivité à la stimulation vive, avec cri franc, et une capacité à être consolé facilement (enfant se calmant à la voix, s’apaisant dans les bras ou à la succion). La motricité spontanée est riche, symétrique et harmonieuse, avec une bonne ouverture des mains, des mouvements indépendants des doigts. Les réflexes ostéotendineux sont présents et symétriques.
L’efficience des fonctions sensorielles doit être vérifiée afin de dépister précocement toute anomalie.
Un nouveau-né à terme est capable de fixation oculaire puis de poursuite oculaire horizontale (qui doit être acquise à 2-3 mois de vie) en s’aidant d’un objet contrasté comme une cible noir/blanc placée à environ 30 cm ; il cligne des paupières à la lumière vive.
Le nouveau-né réagit aux bruits et à la voix. En dehors d’anomalies du pavillon de l’oreille, il n’y a pas de signe clinique spécifique qui permette d’évoquer une surdité, ce qui justifie un dépistage systématique (voir au chapitre 4 § II. Dépistage des troubles auditifs).
10. Examen ostéoarticulaire
Le rachis doit être palpé sur toute sa hauteur à la recherche d’une anomalie cutanée et/ou osseuse (par exemple une angulation).
Une anomalie de fermeture du tube neural (spina bifida) doit être suspectée devant la présence dans la région lombosacrée d’un lipome sous-cutané, d’une touffe de poils, d’une fossette sacrococcygienne profonde (fig. 44.10) et/ou avec pertuis ou encore d’une déviation du sillon interfessier. Ces signes imposent une échographie médullaire.
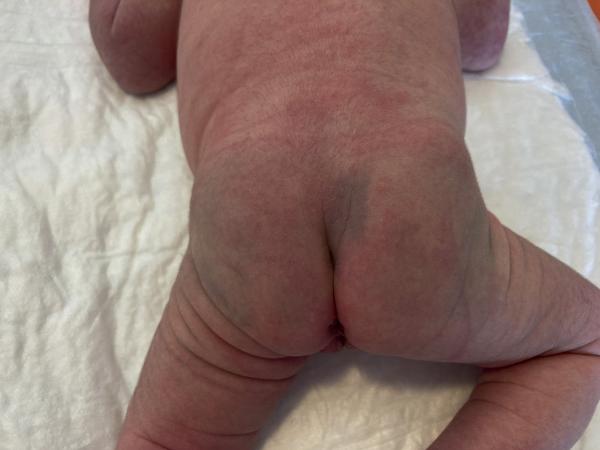
Fig. 44.10. ![]() Siège d’un nouveau-né avec fossette sacro-coccygienne et tache ethnique ardoisée.
Siège d’un nouveau-né avec fossette sacro-coccygienne et tache ethnique ardoisée.
Source : Elsa Kermorvant.
L’examen vérifie également l’intégrité morphologique des membres et le bon fonctionnement et la souplesse des articulations (amplitudes normales et symétriques).
Les principales malformations sont surtout localisées aux extrémités (syndactylie = accolement de deux doigts ou orteils ; polydactylie = doigts surnuméraires ; hypoplasies et aplasies des doigts ou orteils). Les malpositions des pieds, fréquentes et bénignes, sont des déformations simples, réductibles (pathologie posturale secondaire aux contraintes utérines), comme les pieds varus ou la clinodactylie (chevauchement des orteils). Il faut les distinguer des déformations rigides (non réductibles), malformatives, comme les pieds bots varus équins.
L’examen des hanches doit être soigneux et répété les premiers mois de vie, à la recherche de signes évoquant une luxation congénitale des hanches (voir au chapitre 4, § III. Dépistage des anomalies orthopédiques).
Enfin, l’examen recherche des lésions traumatiques du per-partum : bosse sérosanguine, céphalhématome, hématomes cutanés, paralysie faciale (forceps), paralysie du plexus brachial (asymétrie de la gesticulation spontanée des membres supérieurs), fracture de clavicule, exceptionnellement fracture de membre ou du crâne. Un purpura d’origine mécanique peut être observé au niveau de la face ou du vertex à la suite d’une extraction difficile, d’une circulaire serrée du cordon ou encore d’une présentation de la face.
Données indispensables de l’examen d’un nouveau-né : température et évolution pondérale des premiers jours de vie, coloration et ictère, souffle cardiaque et pouls fémoraux, tonus et réflexes archaïques, hépatomégalie et splénomégalie, malformations, organes génitaux externes et orifices herniaires, dépistages sensoriels et de la luxation congénitale de hanche.
C. Critères pédiatriques de maturation d’un nouveau-né à terme
1. Âge gestationnel
L’âge gestationnel est exprimé en semaines d’aménorrhée révolues (SA).
Il est déterminé avant la naissance (critères obstétricaux) à l’échographie de 10–12 SA (précision de 3 à 5 jours près) ou à défaut grâce à la date des dernières règles (imprécise dans 20 à 30 % des cas). Par définition, le nouveau-né est à terme quand il est né entre 37 et 41 SA ; un nouveau-né est prématuré quand il est né avant 37 SA.
En l’absence de ces paramètres, la maturation peut être appréciée par des critères morphologiques cliniques (par exemple, tissu mammaire, plis plantaires, cartilage auriculaire, aspects des organes génitaux externes ; fig. 44.11) et par des éléments de l’examen neurologique : le tonus et les automatismes primaires.
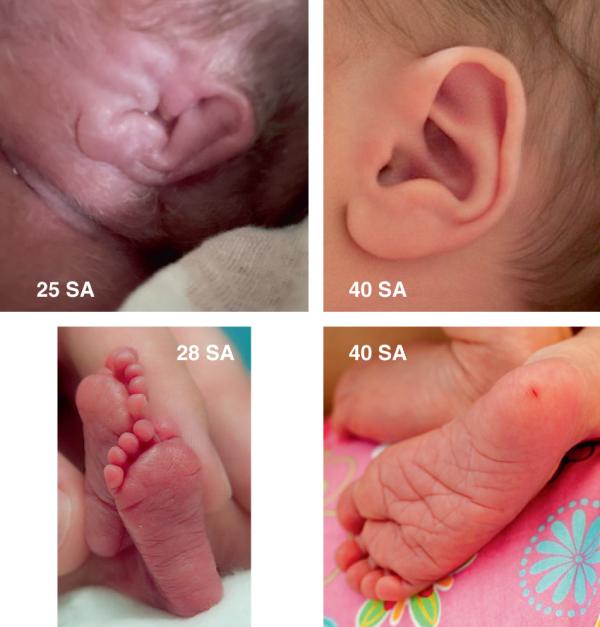
Fig. 44.11. ![]() Critères morphologiques de maturation : cartilage des oreilles, plis plantaires.
Critères morphologiques de maturation : cartilage des oreilles, plis plantaires.
Source : Cyril Flamant.
2. Tonus passif et actif
Tonus passif
Plus l’enfant est mature, plus sa posture passive est en flexion ; l’analyse de la posture spontanée chez l’enfant à terme est normalement en quadriflexion (prépondérance des fléchisseurs).
Le tonus passif est évalué par les manœuvres suivantes :
- retour en flexion (après extension des membres supérieurs par l’examinateur) ;
- signe du foulard (quand l’examinateur rapproche une main vers l’épaule controlatérale, le coude ne dépasse pas la ligne médiane) ;
- et l’examen des angles (fig. 44.12) : angle poplité ≤ 90° (angle d’extension passive de la jambe sur la cuisse), angle de dorsiflexion du pied entre 0 et 20° (flexion du pied sur la jambe), angle talon-oreille ≤ 90° (mouvement de rapprochement du talon vers le visage), angle des adducteurs entre 40 et 70° (mouvement d’abduction des hanches).
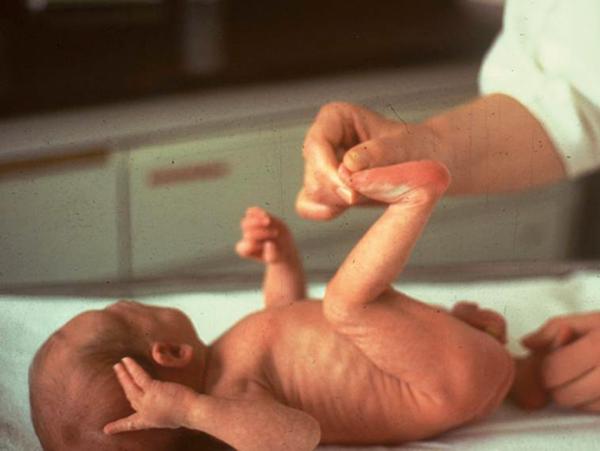
Fig. 44.12. ![]() Mesure d’un angle poplité chez un nouveau-né à terme PAG.
Mesure d’un angle poplité chez un nouveau-né à terme PAG.
Source : Cyril Flamant.
Tonus actif
- La manœuvre du tiré-assis (en tenant l’enfant par les épaules) teste la réponse motrice des muscles fléchisseurs du cou (tiré) puis des extenseurs du cou (assis) ; la tête est normalement maintenue dans l’axe pendant quelques secondes, la réponse est symétrique (fig. 44.13).
- Celle du redressement global la complète : maintenu en suspension ventrale (thorax soutenu par les mains de l’examinateur), le nouveau-né redresse ses membres inférieurs puis son tronc et sa tête pendant quelques secondes.
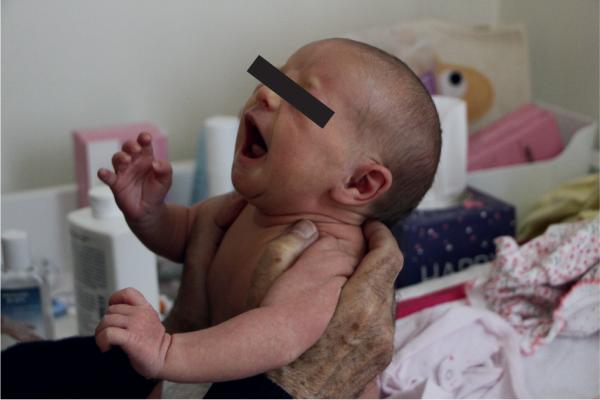
Fig. 44.13. ![]() Évaluation du tonus actif (manœuvre du tiré-assis)
Évaluation du tonus actif (manœuvre du tiré-assis)
Source : Antoine Bourrillon.
3. Automatismes primaires
Les automatismes primaires (ou réflexes archaïques) sont des réactions motrices propres aux premiers mois de vie (tableau 44.3). Ils sont tous présents chez le nouveau-né à terme.
Leur absence chez un nouveau-né à terme est toujours pathologique ; leur présence en revanche ne témoigne pas pour autant de l’intégrité du système nerveux central. Ils disparaissent habituellement entre 2 et 4 mois de vie.
Tableau 44.3. ![]() Automatismes primaires.
Automatismes primaires.
| Succion | Elle est intense, rythmée, sans fatigue ni changement de teint |
| Points cardinaux | La stimulation des commissures labiales entraîne la rotation de la tête et l’ouverture de la bouche du nouveau-né, qui cherche ainsi à téter |
| Agrippement (grasping) | La stimulation de la paume des mains (ou de la plante des pieds) entraîne une flexion spontanée des doigts (ou des orteils) et l’agrippement du doigt de l’examinateur (fig. 44.14A) |
| Réflexe de Moro | Une extension brutale de la nuque entraîne une extension des quatre membres, une ouverture des mains, ± suivies d’un cri (fig. 44.14B) |
| Allongement croisé | La stimulation de la plante d’un pied, le membre inférieur étant maintenu en extension, entraîne le retrait (la flexion) puis l’extension du membre inférieur controlatéral |
| Marche automatique | Chez un nouveau-né soutenu au niveau du tronc en position debout et penchée en avant, le contact des plantes des pieds avec la table d’examen entraîne un réflexe de retrait en alternance des membres inférieurs donnant une impression de marche (fig. 44.14C) |
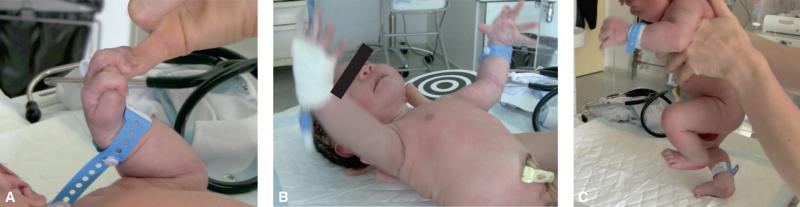
Fig. 44.14. ![]() Automatismes primaires.
Automatismes primaires.
A. Grasping. B. Réflexe de Moro. C. Marche automatique.
Source : Elsa Kermorvant.
II. Dépistages systématiques néonatals
A. Dépistage sanguin (« Guthrie »)
1. Généralités
Le programme national de dépistage néonatal répond aux critères OMS (Organisation mondiale de la santé) du dépistage :
- problème de santé publique, maladie fréquente et/ou grave ;
- physiopathologie connue, évolution grave en l’absence de traitement précoce ;
- test fiable et reproductible, peu coûteux, acceptable par la population.
Le dépistage néonatal est réalisé de manière systématique autour de 72 heures de vie et impérativement au-delà de 48 heures, au mieux avant la sortie de la maternité. Le prélèvement consiste à déposer sur un papier buvard nominatif 8 à 10 gouttes de sang.
Anciennement appelé « Guthrie » (premier test dépistant uniquement la phénylcétonurie), il concerne aujourd’hui treize maladies et est intégralement financé par l’Assurance maladie.
Une information claire et compréhensible doit être donnée aux parents. Leur consentement écrit est sollicité avant le prélèvement. Le dépistage de la mucoviscidose requiert en effet, si le taux de trypsine immunoréactive est élevé, une étude génétique.
Les parents ne sont avertis qu’en cas de résultat anormal, nécessitant alors un test de contrôle et éventuellement une confirmation diagnostique par des examens orientés.
2. Maladies dépistées
Phénylcétonurie
Elle concerne 1/16 000 nouveau-nés en France.
C’est une maladie génétique autosomique récessive, liée à un déficit en phénylalanine hydroxylase, enzyme permettant la transformation de la phénylalanine en tyrosine.
Elle est responsable, en l’absence de traitement, d’un retard psychomoteur sévère.
Le marqueur utilisé pour le dépistage est le dosage sanguin de la phénylalanine, suspect si élevé.
Hypothyroïdie congénitale (voir chapitre 1)
Elle concerne 1/3 000 nouveau-nés en France.
Elle est liée à une sécrétion insuffisante d’hormones thyroïdiennes (T4L et T3L) par la thyroïde, soit par dysgénésie thyroïdienne (athyréose, ectopie thyroïdienne, hémi-agénésie ; 60 % des cas), soit par trouble de l’hormonosynthèse thyroïdienne (hypothyroïdie avec glande en place ; 40 % des cas).
Elle est responsable, en l’absence de traitement, d’un retard psychomoteur irréversible et d’un retard de croissance sévère. Les signes cliniques pouvant être observés en période néonatale sont une macroglossie, des fontanelles et des sutures larges, un ictère (à bilirubine libre) prolongé, une constipation, une hypotonie et une mauvaise prise de poids.
Le marqueur utilisé pour le dépistage est le dosage sanguin de la TSH. En cas de TSH élevée (évocatrice d’hypothyroïdie périphérique), le bilan hormonal (T4L, T3L et TSH) permet de confirmer le diagnostic d’hypothyroïdie, une échographie et une scintigraphie de la thyroïde permettent d’en déterminer l’étiologie. Les hypothyroïdies d’origine centrale (T3L et T4L basses associées à une TSH basse) ne sont donc pas dépistées, mais elles sont beaucoup plus rares et souvent associées à d’autres déficits hormonaux qui permettent le diagnostic.
Hyperplasie congénitale des surrénales (voir chapitre 6)
Elle concerne 1/15 000 nouveau-nés en France.
La cause la plus fréquente est le déficit enzymatique en 21-hydroxylase qui se manifeste par une augmentation du métabolite en amont, la 17-hydroxyprogestérone (17-OHP).
Chez les filles, la production excessive d’androgènes surrénaliens peut se manifester par une virilisation des organes génitaux externes visible dès la naissance (hyperplasie du clitoris, fusion des grandes lèvres). Dans les deux sexes, en l’absence de traitement, elle se manifeste vers la fin de la première semaine de vie par des signes de déficit en aldostérone (syndrome de perte de sel avec déshydratation et signes digestifs, hyponatrémie et hyperkaliémie) et en cortisol (hypoglycémie).
Le marqueur utilisé pour le dépistage est le dosage sanguin de la 17-OHP, suspect si élevée. Le dépistage ne permet le diagnostic que des formes sévères (« classiques ») de la maladie.
Mucoviscidose (voir chapitre 63)
La mucoviscidose peut être symptomatique dès la naissance (iléus méconial).
Le marqueur utilisé pour le dépistage est le dosage sanguin de la trypsine (TIR, trypsine immunoréactive), suspect si élevé au-delà d’un seuil fixé. En cas d’hypertrypsinémie, une analyse génétique est effectuée (consentement écrit des parents indispensable).
Drépanocytose (voir chapitre 23)
Seule une population ciblée était jusqu’alors concernée par ce dépistage, lorsque les parents sont originaires de pays considérés comme à risque (Afrique avant tout subsaharienne, Antilles, Guyane, Réunion, bassin méditerranéen) ; mais la HAS a demandé sa généralisation à toute la population.
Le marqueur utilisé pour le dépistage est l’électrophorèse de l’hémoglobine S, permettant la mise en évidence d’une bande spécifique HbS et l’absence d’une bande HbA.
Déficit en MCAD
Il concerne 1/15 000 nouveau-nés en France.
Le déficit en MCAD (acyl-coenzyme A déshydrogénase des acides gras à chaînes moyennes) est l’anomalie la plus fréquente de la β-oxydation des acides gras, processus biochimique indispensable pour le métabolisme énergétique de l’organisme. Il s’agit d’une maladie autosomique récessive liée à des mutations du gène ACADM.
Il se traduit par un défaut d’utilisation des acides gras responsable d’une hypoglycémie de jeûne dès que la néoglucogenèse est insuffisante pour couvrir les besoins énergétiques. Il s’agit d’une maladie potentiellement grave, qui se manifeste par des malaises hypoglycémiques hypocétosiques (voir chapitre 8).
Le dépistage repose sur la mesure de l’octanoyl-carnitine (C8) par spectrométrie de masse.
Autres maladies dépistées
Depuis le 1er janvier 2023, sept autres erreurs innées du métabolisme sont également recherchées par spectrométrie de masse :
- trois amino-acidopathies : homocystinurie, leucinose, tyrosinémie de type 1 ;
- deux aciduries organiques : acidurie glutarique de type 1, acidurie isovalérique ;
- deux autres déficits de la β-oxydation des acides gras : déficit en LCHAD (3-hydroxyacyl-coenzyme A déshydrogé
B. Autres dépistages
Les autres dépistages sont détaillés dans le chapitre 4.
La recherche d’une luxation congénitale de hanche est systématique à la maternité puis lors des examens de suivi les premiers mois.
Les OEAP et/ou PEAA permettent le dépistage de la surdité congénitale. Ils sont effectués à partir de J3, idéalement avant la sortie de maternité.
La recherche d’anomalies de l’examen des yeux et de la fonction visuelle est aussi un impératif de dépistage dès cet âge.
Dépistage néonatal :
- papier buvard : phénylcétonurie, hypothyroïdie, hyperplasie congénitale des surrénales, mucoviscidose (si + : recherche de mutations génétiques, avec accord écrit parental), drépanocytose, déficit en MCAD, homocystinurie, leucinose, tyrosinémie de type 1, acidurie glutarique de type 1, acidurie isovalérique, déficit en LCHAD, déficit en captation de carnitine ;
- autres dépistages : luxation congénitale de hanche, surdité congénitale, anomalies visuelles.
III. Promouvoir la qualité des premiers liens affectifs entre parents et enfant et expliquer les bases de la puériculture
A. Liens affectifs entre parents et enfant
En salle de naissance, après s’être assuré que l’adaptation néonatale est normale, le contact physique mère-enfant doit être privilégié quel que soit le mode d’accouchement : poser le nouveau-né sur le ventre de la mère tout en s’assurant de sa surveillance, effectuer une première mise au sein précoce si la mère souhaite allaiter, faire les premiers soins en présence des parents.
Les suites de couches sont un lieu d’apprentissage, d’échanges, où les parents et l’enfant font connaissance. L’accompagnement à l’apprentissage des soins au nouveau-né permet de faire découvrir les compétences du nouveau-né et d’accroître la confiance des parents dans leurs capacités. Il permet l’expression des difficultés éventuelles, l’observation des comportements et la mise en place d’une véritable éducation pour la santé.
B. Allaitement maternel
1. Bénéfices de l’allaitement maternel
Le choix du mode d’alimentation du nourrisson a des répercussions sur sa santé et son développement, sur la santé de la mère et sur la relation mère-enfant.
Le lait maternel est le lait le plus adapté pour la croissance et le développement du nourrisson. L’OMS recommande un allaitement maternel exclusif pendant une durée de 6 mois. L’alimentation doit être diversifiée, chez les enfants allaités comme ceux qui ne sont pas allaités, entre 4 et 6 mois.
Pour l’enfant, les avantages de l’allaitement maternel (d’autant plus significatifs qu’il est exclusif et prolongé) sont de :
- correspondre à un véritable modèle nutritionnel et être adapté constamment aux besoins physiologiques de l’enfant (modification de sa composition avec le nycthémère, le moment de la tétée, l’âge de l’enfant et son terme) ;
- diminuer le risque infectieux (gastro-entérites, otites, infections respiratoires) ;
- participer à prévenir les maladies atopiques (asthme, dermatite atopique) ;
- favoriser les interactions mère-enfant ;
- constituer un avantage socio-économique (meilleure protection contre la dénutrition dans les pays en voie de développement).
Chez l’enfant prématuré, les bénéfices spécifiques de l’allaitement sont l’amélioration de la tolérance digestive, la réduction du risque d’entérocolite ulcéro-nécrosante et l’amélioration du développement cognitif.
Pour la mère, les avantages de l’allaitement maternel sont de diminuer le risque de diabète de type 2, de cancer du sein et de l’ovaire, de faciliter une perte de poids progressive après la grossesse chez les mères en surcharge pondérale avant la grossesse, de diminuer la réponse au stress et d’améliorer le bien-être et l’estime de soi.
La promotion de l’allaitement maternel en France est l’un des objectifs du Programme national Nutrition Santé. Le Code du travail prévoit des mesures pour encourager la poursuite de l’allaitement maternel (pauses sur le temps de travail, réduction journalière du temps de travail ou horaires de travail souples, lieux appropriés pour exprimer le lait).
Les données épidémiologiques indiquent que 70 % des mères françaises allaitent à la sortie de la maternité. L’implication des soignants (notamment en maternité) doit être exemplaire pour la promotion de l’allaitement.
L’OMS recommande un allaitement maternel exclusif pendant une durée de 6 mois.
Promotion de l’allaitement, notamment en maternité.
2. Modalités pratiques
Une information sur l’allaitement maternel doit être délivrée pendant la grossesse. Un démarrage précoce est crucial pour la mise en place d’une lactation efficace. Une première tétée doit être ainsi favorisée dans l’heure qui suit la naissance.
La mère doit être informée sur la bonne position du nouveau-né (ventre de l’enfant contre le sien, avec oreille, épaule et hanche alignées) et la prise correcte du sein par l’enfant, qui permettent une succion efficace (rythme lent et régulier, déglutition audible) et un transfert de lait optimal tout en prévenant les tétées douloureuses et les lésions du mamelon.
L’hygiène des mamelons requiert simplement une toilette quotidienne à l’eau et au savon. Il n’existe aucun médicament ou régime influençant favorablement la sécrétion lactée. L’arrêt du tabagisme doit être encouragé et la consommation d’alcool évitée.
Chez le nouveau-né à terme bien portant, le rythme et la durée des tétées sont déterminés par l’enfant selon ses besoins (allaitement à l’éveil), avec une moyenne de 8 à 12 tétées par jour les premières semaines, sur les deux seins.
Il n’est pas nécessaire de peser quotidiennement le nouveau-né (en dehors des premiers jours de vie) ni avant et après les tétées pour évaluer la quantité bue. La satisfaction de l’enfant, des mictions abondantes (au moins 5–6 couches lourdes par jour), des selles pluriquotidiennes et une prise pondérale de 200–250 g par semaine témoignent du succès de l’allaitement.
Une perte de poids est physiologique au cours de la première semaine de vie ; elle est en moyenne de 7,5 % du poids de naissance (et ne doit pas dépasser 10 %). Le poids de naissance doit être repris avant J10 de vie.
Pour prévenir le risque de maladie hémorragique, de la vitamine K (2 mg per os) est prescrite à l’âge de 1 mois en cas d’allaitement maternel exclusif, sans oublier une supplémentation en vitamine D (400 à 800 UI par jour).
Allaitement maternel exclusif : penser à la vitamine K à 1 mois de vie.
3. Complications de l’allaitement
L’ictère au lait de mère est sans gravité (voir chapitre 45).
Les difficultés de succion de l’enfant, plus fréquentes s’il est immature, peuvent rendre nécessaire l’utilisation temporaire d’un tire-lait.
L’insuffisance de lait est le plus souvent la conséquence d’une conduite inappropriée de l’allaitement (tétées inefficaces et/ou trop peu nombreuses) à l’origine d’une diminution du transfert de lait au nourrisson et de la sécrétion lactée. Elle nécessite des conseils et un soutien visant à restaurer la confiance de la mère dans ses compétences, et, pour stimuler la sécrétion lactée, des mises au sein plus fréquentes.
Les douleurs et crevasses des mamelons sont fréquentes. Elles sont secondaires à une friction anormale du mamelon avec la cavité buccale de l’enfant en relation avec un mauvais positionnement qu’il faut rechercher et s’attacher à corriger.
L’engorgement correspond à une tension très douloureuse des seins contemporaine de la montée de lait avec œdème résultant d’une stase capillaire et lymphatique, qui devient pathologique lorsqu’elle s’accompagne de fièvre, douleur et gêne à l’écoulement du lait. Il faut préconiser l’expression du lait (manuelle ou à l’aide d’un tire-lait) qui réduit la stase lactée, suivie d’une tétée par le bébé. La restriction hydrique, le bandage des seins aggravent l’inconfort de la mère et ne sont pas recommandés.
La lymphangite (anciennement mastite) est une inflammation du sein pouvant évoluer vers une infection. Les signes cliniques sont habituellement unilatéraux, allant de la simple inflammation localisée d’un segment du sein avec rougeur, douleur et augmentation de la chaleur locale, à un aspect beaucoup plus sévère de cellulite avec « peau d’orange ». Ces signes locaux peuvent précéder ou s’associer à des signes généraux (fièvre ou symptômes pseudogrippaux). Le traitement repose sur un drainage du sein efficace (tétées sans restriction de durée ni de fréquence, extraction avec un tire-lait). Suspendre l’allaitement expose au développement d’un abcès du sein. Un antibiotique est indiqué si les symptômes sont graves d’emblée, si une lésion du mamelon est visible ou encore si les symptômes ne s’améliorent pas en 12 à 24 heures. L’antibiotique prescrit sera compatible avec l’allaitement et à visée antistaphylococcique et antistreptococcique.
4. Contre-indications : allaitement et médicaments, infections et toxiques
Les véritables contre-indications permanentes à l’allaitement sont peu nombreuses : infection maternelle par le VIH (pays industrialisés uniquement), cardiopathie ou néphropathie sévère chez la mère, galactosémie chez l’enfant, ou encore certains médicaments sans alternative thérapeutique présentant un risque pour l’enfant (antimitotiques, lithium). Le centre de référence sur les agents tératogènes ou encore les lactariums mettent à disposition des professionnels de santé des données exhaustives concernant les risques des médicaments en cas d’allaitement.
Ictère au lait de mère : ne pas interrompre l’allaitement maternel.
C. Conseils pratiques aux parents
1. Conseils de base de puériculture
Le change doit être effectué après chaque tétée. Chez la fille, la toilette vulvaire doit se faire de haut en bas pour éviter la contamination par les selles.
La toilette est un moment privilégié qui permet aux parents de prendre soin du corps de leur enfant, en établissant avec lui les premières relations affectives.
Ne pas utiliser de coton-tige pour les oreilles, mais recueillir les sécrétions au niveau du pavillon. Ne pas essayer de décalotter le petit garçon.
2. Suivi médical
Les parents doivent être informés de la nécessité d’un suivi médical régulier (voir chapitre 5).
Il permet de vérifier la normalité du développement psychomoteur, de la croissance staturo-pondérale et du PC, d’effectuer des dépistages (notamment neurosensoriels), de donner des conseils pour l’alimentation et la diversification, et d’effectuer les vaccinations.
3. Mesures de prévention dans les premières années de vie
Les mesures de prévention de la mort inattendue du nourrisson (MIN) doivent être expliquées (voir chapitre 9).
Des mesures de prévention de la transmission des infections doivent également être mises en œuvre (lavage des mains avant chaque soin à l’enfant et avant la préparation des repas, évitement du contact rapproché du visage et des mains des personnes enrhumées).
Les parents doivent être informés des risques du tabagisme passif (MIN, asthme du nourrisson), de la nécessité de consulter rapidement en cas de problème médical (fièvre avant 3 mois, difficultés alimentaires, gêne respiratoire, diarrhée, vomissements, comportement inhabituel) et d’apporter toujours le carnet de santé.
Il est important de prévenir les accidents domestiques : chutes (fenêtres, escaliers), noyade (bain, piscine), asphyxie (sacs plastiques), inhalation de corps étrangers (petits aliments et objets), brûlures (bain trop chaud, lait chauffé au four à micro-ondes, prises électriques) et intoxications (médicaments, produits d’entretien).
L’exposition aux écrans avant 3 ans doit être proscrite.
Il ne faut jamais secouer un nourrisson pour le faire taire ou pour jouer, ni laisser un bébé seul à domicile ou dans une voiture.
Conseils : prévention de la MIN, arrêt du tabagisme parental, conduite à tenir en cas de fièvre.
D. Sortie de la maternité
La mise à jour du carnet de santé est obligatoire à la sortie de la maternité.
Celui-ci précise les informations apportées par l’examen clinique en maternité, la date de réalisation des dépistages obligatoires, le régime choisi (allaitement maternel ou artificiel), ainsi que le poids de sortie.
L’ordonnance de sortie de maternité comporte la prescription des supplémentations vitaminiques recommandées, les soins du cordon ombilical jusqu’à sa chute.
Une consultation par un pédiatre est recommandée au cours de la 2e semaine de vie (d’autant plus rapidement que la sortie de maternité est précoce).
Une pesée hebdomadaire est recommandée le premier mois en cas d’allaitement maternel.
Remise du carnet de santé et explication du suivi médical systématique.
IV. Reconnaître les situations à risque et les situations pathologiques nécessitant une prise en charge spécialisée
Les situations à risque et les situations pathologiques pour le nouveau-né sont récapitulées dans le tableau 44.4.
Tableau 44.4. ![]() Situations à risque et situations pathologiques pour le nouveau-né en maternité.
Situations à risque et situations pathologiques pour le nouveau-né en maternité.
| Situations à risque |
|
| Situations pathologiques |
|
A. Prématurité
1. Définition
La prématurité est définie par un terme de naissance inférieur à 37 SA.
On distingue (définitions OMS) la prématurité moyenne, voire tardive (naissance entre 32 et 36 SA + 6 jours), la grande prématurité (naissance entre 28 et 31 SA + 6 jours) et la très grande prématurité (ou prématurité extrême) (naissance entre 22 SA et 27 SA + 6 jours). La limite de viabilité est un terme ≥ 22 SA ou un poids ≥ 500 g.
On distingue également la prématurité spontanée et la prématurité induite (ou consentie) résultant d’une décision médicale d’arrêter la grossesse avant son terme pour une pathologie maternelle ou fœtale.
La prévalence de la prématurité est estimée à 7–8 % des naissances.
La très grande majorité des nouveau-nés prématurés naît entre 32 et 36 SA.
La très grande prématurité (< 28 SA) est la plus forte cause de morbidité (50 % des infirmités motrices d’origine cérébrale, IMOC) et de mortalité périnatales (50 % des décès).
Prématurité = naissance avant 37 SA.
2. Causes
Il existe le plus souvent plusieurs facteurs de risque et étiologiques intriqués (traités par le Collège des enseignants en obstétrique).
3. Complications
Généralités
Le nouveau-né prématuré est caractérisé par l’immaturité de toutes ses fonctions physiologiques, à l’origine des pathologies spécifiques de la prématurité (tableau 44.5).
Tableau 44.5. ![]() Risques et complications liés à l’immaturité.
Risques et complications liés à l’immaturité.
| Immaturité générale | Thermique | – Hypothermie |
| Immunitaire | – Infections néonatales bactériennes précoces et nosocomiales | |
| Métabolique | – Anémie – Hypoglycémie, hypocalcémie |
|
| Immaturité d’organes | Cérébrale | – Hémorragies intraventriculaires – Leucomalacie périventriculaire – Apnées |
| Pulmonaire | – Maladie des membranes hyalines – Apnées – Dysplasie bronchopulmonaire |
|
| Cardiaque | – Persistance d’un canal artériel perméable | |
| Digestive | – Entérocolite ulcéronécrosante – Difficultés d’alimentation (dues à l’immaturité de la succion-déglutition avant 34 SA et à celle de la motricité digestive) |
|
| Hépatique | – Ictère – Hypoglycémie |
|
| Ophtalmique | – Rétinopathie du prématuré |
Maladie des membranes hyalines (MMH)
La MMH est secondaire à un déficit en surfactant, conduisant à un collapsus alvéolaire. Elle est d’autant plus fréquente que l’enfant est plus immature.
Le tableau clinique est une détresse respiratoire aiguë (fig. 44.15), sans intervalle libre par rapport à la naissance, avec geignement expiratoire.
Sa prévention repose sur une corticothérapie prénatale maternelle en cas de risque de prématurité avant le terme de 34 SA.
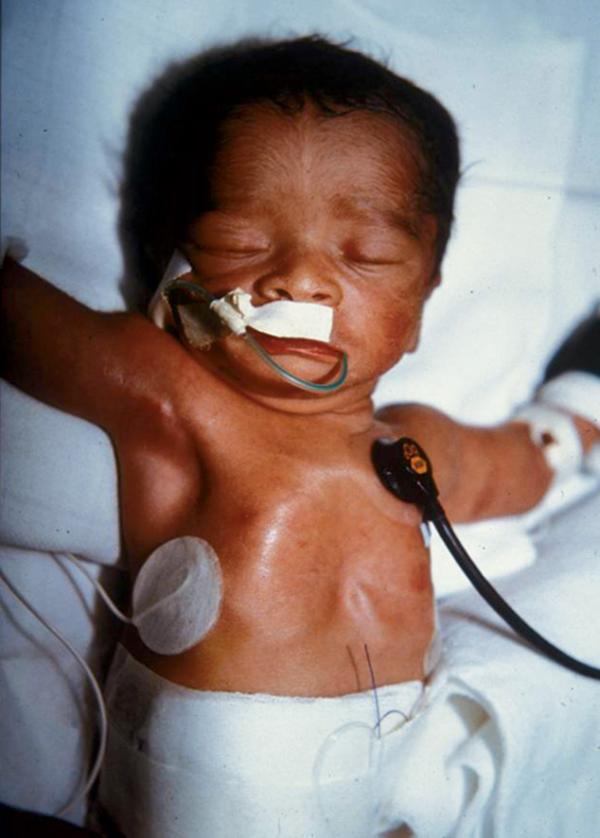
Fig. 44.15. ![]() Signes de lutte chez un prématuré.
Signes de lutte chez un prématuré.
Apnées et bradycardies
Les apnées sont secondaires à une immaturité de la commande respiratoire du SNC.
Elles sont prévenues par l’administration quotidienne de caféine, systématique avant 32 SA d’âge post-conceptionnel (terme + nombre de semaines de vie extra-utérine).
Dysplasie bronchopulmonaire
Elle résulte d’une altération de la croissance alvéolaire liée à l’immaturité pulmonaire et aggravée par des facteurs comme la ventilation assistée et l’hyperoxie. Elle est d’autant plus fréquente que l’enfant est plus immature.
Elle est définie par la persistance d’une oxygénodépendance (ou de la nécessité d’un soutien ventilatoire) à 36 SA d’âge post-conceptionnel.
Conséquences de l’immaturité digestive
L’immaturité de la coordination succion-déglutition-respiration rend nécessaire l’alimentation par sonde gastrique jusqu’aux alentours de 35 SA d’âge post-conceptionnel.
L’immaturité des fonctions digestives et du péristaltisme rend nécessaire la progression prudente des rations alimentaires et une nutrition parentérale de complément prolongée chez les enfants les plus immatures.
Entérocolite ulcéro-nécrosante (ECUN)
L’ECUN est une pathologie d’origine multifactorielle potentiellement gravissime, caractérisée par une nécrose ischémo-hémorragique plus ou moins étendue des parois du côlon et/ou du grêle, pouvant se compliquer de perforation.
Leucomalacie périventriculaire cavitaire
Devenue rare, elle est définie par des lésions de nécrose de la substance blanche périventriculaire.
Elle représente un facteur de risque majeur de séquelles neurodéveloppementales à long terme (voir infra).
Les formes d’atteinte diffuse de la substance blanche secondaires à des anomalies des oligodendrocytes sont plus fréquentes.
Le nouveau-né prématuré est caractérisé par l’immaturité de toutes ses fonctions physiologiques, à l’origine de pathologies spécifiques, notamment respiratoires (maladie des membranes hyalines, dysplasie bronchopulmonaire) et neurosensorielles (hémorragies intraventriculaires, leucomalacie périventriculaire et rétinopathie du prématuré).
La corticothérapie anténatale en cas de menace d’accouchement prématuré jusqu’à 34 SA est un facteur majeur de prévention des complications de la prématurité (MMH). L’administration de sulfate de magnésium à la mère en cas d’accouchement avant 32 SA améliore le devenir neurologique des enfants nés prématurés.
4. Devenir à long terme
Le risque de décès concerne surtout les extrêmes prématurés.
Le risque de séquelles est d’autant plus important que l’enfant est prématuré. Le risque de séquelles graves et de handicap concerne essentiellement les enfants nés avant 28 SA. Ainsi, la majorité des prématurés qui naissent après 32 SA ont une évolution favorable. Le risque de troubles des apprentissages à l’âge scolaire reste possible en cas de naissance avant 34 SA.
Suivi médical prolongé pour l’ancien prématuré en particulier neurodéveloppemental.
B. Retard de croissance intra-utérin (RCIU)
1. Définitions
Le petit poids pour l’âge gestationnel, ou PAG (équivalent français de Small for Gestational Age, SGA) est défini par un poids isolé (estimation pondérale in utero ou poids de naissance) inférieur au 10e percentile. Le PAG sévère correspond à un PAG inférieur au 3e percentile.
Le retard de croissance intra-utérin, ou RCIU (équivalent français de fetal growth restriction ou intra-uterine growth retardation) correspond le plus souvent à un PAG associé à des arguments en faveur d’un défaut de croissance pathologique : arrêt ou infléchissement de la croissance de manière longitudinale (au moins deux mesures à 3 semaines d’intervalle).
Plus rarement, un RCIU peut correspondre à un défaut de croissance, avec un poids proche du 10e percentile sans être PAG.
Dans les situations de PAG sur une mesure isolée, l’existence de signes d’altération du bien-être fœtal (diminution des mouvements fœtaux, anomalies du doppler, oligoamnios) doit faire évoquer un RCIU. Les enfants PAG sont soit des enfants constitutionnellement petits, soit d’authentiques RCIU. Les recommandations précisent qu’il est souhaitable de supprimer du vocabulaire les dénominations « hypotrophe » et « RCIU symétrique/asymétrique ».
RCIU : PAG associé à des arguments en faveur d’un défaut de croissance pathologique ou défaut de croissance avec poids proche du 10e percentile (sans PAG).
2. Causes
Les causes des RCIU relèvent de l’enseignement du Collège d’obstétrique.
3. Complications
Principales complications néonatales :
- asphyxie périnatale, par moins bonne tolérance des contractions utérines (risque d’encéphalopathie anoxo-ischémique et d’inhalation de liquide amniotique méconial) ;
- hypothermie et troubles métaboliques (hypoglycémie, hypocalcémie) par insuffisance de réserves ;
- polyglobulie (risque augmenté de thrombose vasculaire et d’ictère), secondaire à l’hypoxie fœtale chronique ;
- surmortalité et augmentation du risque de morbidité respiratoire et digestive (ECUN) en cas de prématurité associée.
À long terme :
- augmentation du risque de troubles du neurodéveloppement, surtout en cas de mauvaise croissance du périmètre crânien ;
- absence de rattrapage de croissance et retard de croissance persistant (10 à 15 %) ;
- augmentation du risque de syndrome métabolique (diabète, obésité) et d’HTA à l’âge adulte.
4. Prise en charge, suivi, facteurs pronostiques
Éléments de prise en charge à la naissance
La prise en charge d’un nouveau-né PAG non prématuré comporte des mesures de prévention de l’hypothermie (mise en incubateur) et de l’hypoglycémie (nutrition entérale précoce, éventuellement complétée par voie intraveineuse).
Suivi
Les modalités de suivi à distance sont proches de celles des prématurés.
La surveillance de la croissance staturo-pondérale est essentielle et repose sur l’analyse des courbes (carnet de santé). Le rattrapage staturo-pondéral est habituel avant la fin de la deuxième année de vie, avec une croissance rapide du PC. Les enfants présentant un retard statural persistant peuvent bénéficier d’un traitement par hormone de croissance.
Principaux facteurs pronostiques
Les principaux facteurs pronostiques associés à un risque de morbidité et de séquelles neurodéveloppementales accru sont la prématurité associée, un retard de croissance de la taille et du périmètre crânien associé, certaines complications néonatales (asphyxie, hypoglycémie), certaines causes de RCIU (causes génétiques, infectieuses, alcoolisation fœtale), des anomalies de la croissance postnatale (périmètre crânien avant tout, mais aussi poids).
Le RCIU expose le nouveau-né à une mortalité et à une morbidité respiratoire, digestive et neurologique accrues, et à l’augmentation du risque de syndrome métabolique et de maladies cardiovasculaires à l’âge adulte.
C. Situations à risque liées à des pathologies maternelles
1. Diabète au cours de la grossesse
Diabète préalable à la grossesse
Le diabète expose à des risques fœtaux et néonatals nombreux.
L’hyperglycémie maternelle périconceptionnelle et pendant le premier trimestre de grossesse majore le risque de malformations congénitales graves, qui touchent électivement le SNC, le cœur et le squelette. Le risque de prématurité et de mort fœtale in utero est augmenté.
Le fœtus est exposé à un risque de macrosomie (poids > + 2 DS) (fig. 44.16), plus fréquente en cas de mauvais équilibre du diabète en fin de grossesse. Celle-ci est responsable d’une augmentation du risque de complications obstétricales (dystocie des épaules, lésions du plexus brachial, fracture, asphyxie périnatale).
Au cours des premiers jours de vie, le nouveau-né est exposé à un risque élevé d’hypoglycémie néonatale par hyperinsulinisme, d’hypocalcémie, de polyglobulie et d’ictère. Il peut présenter une cardiomyopathie hypertrophique, parfois responsable d’une insuffisance cardiaque. Enfin, le risque de détresse respiratoire, notamment de MMH, est augmenté.
À long terme, l’enfant est exposé à un risque accru d’obésité et d’intolérance au glucose.
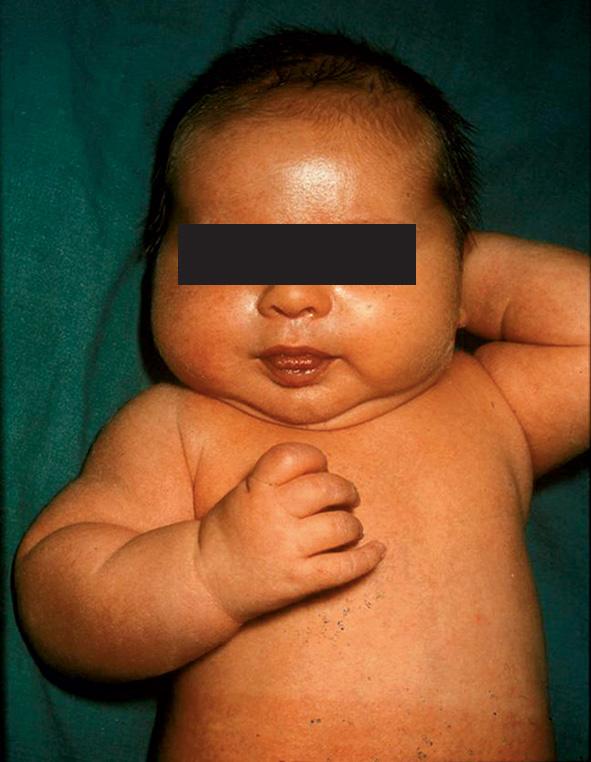
Fig. 44.16. ![]() Nouveau-né macrosome de mère diabétique.
Nouveau-né macrosome de mère diabétique.
La prise en charge de la grossesse est multidisciplinaire, et impose de la programmer afin d’obtenir une normoglycémie en période périconceptionnelle.
Régime, insulinothérapie (contre-indication des antidiabétiques oraux) et autosurveillance des objectifs glycémiques constituent les points essentiels du traitement maternel.
Diabète gestationnel
Il s’agit d’un état d’intolérance au glucose survenant pendant la grossesse chez une femme sans antécédent de diabète préalablement.
Mal équilibré, il peut exposer aux mêmes complications qu’un diabète préalable à la grossesse, à l’exclusion des malformations congénitales (sa survenue est postérieure aux étapes d’organogenèse).
Nouveau-né de mère diabétique : risque majoré de malformations, de macrosomie, de complications obstétricales, d’hypoglycémie, d’hypocalcémie, de cardiomyopathie hypertrophique, de polyglobulie et d’ictère.
Tout diabète pendant la grossesse doit faire l’objet d’une prise en charge rigoureuse visant à atteindre le meilleur équilibre glycémique possible.
2. Herpès génital au cours de la grossesse
Définition et épidémiologie
Un herpès génital maternel doit faire craindre un herpès néonatal, mais ce dernier survient le plus souvent en l’absence d’antécédent, la primo-infection maternelle étant souvent asymptomatique.
L’herpès néonatal est rare mais grave (risque de séquelles neurosensorielles lourdes, décès).
Il s’agit d’une infection à HSV-2 le plus souvent, dont le mode de contamination le plus fréquent est le contact direct avec les sécrétions cervicovaginales maternelles à l’accouchement (autres modes plus rares : passage transplacentaire in utero, période postnatale).
Le risque de contamination est maximal en cas de lésion maternelle évolutive : primo-infection dans le mois précédant l’accouchement, récurrence dans les 7 jours précédant l’accouchement.
Diagnostic
L’herpès néonatal se présente sous trois formes cliniques principales de gravité croissante : cutanéomuqueuse, neurologique, et systémique.
Chez un nouveau-né asymptomatique à la naissance, les signes cliniques sont retardés (entre le 5e et le 12e jour de vie).
La forme cutanéomuqueuse se traduit par une éruption cutanée vésiculopustuleuse, des ulcérations de la muqueuse buccale et une kératoconjonctivite.
La forme neurologique est responsable d’un tableau de méningo-encéphalite, avec des troubles du comportement, des convulsions, et une méningite lymphocytaire.
La forme systémique, de gravité extrême, se traduit par un tableau d’infection sévère avec atteinte multiviscérale notamment hépatique, cardiaque, neurologique et cutanée.
Il est impératif d’assurer la preuve d’une suspicion clinique d’herpès génital en cours de grossesse par des examens virologiques (culture).
La constatation en début de travail de lésions évocatrices d’herpès chez la mère doit conduire à des prélèvements chez elle (lésions cervicovaginales) et chez le nouveau-né (prélèvements oculaires et pharyngés à J2 et J3 de vie) pour détection d’antigènes (immunofluorescence) et/ou culture.
Chez le nouveau-né suspect d’atteinte herpétique, le diagnostic repose sur la mise en évidence du génome viral par PCR dans le LCS et le sang, associée au dosage d’interféron α.
Les sérologies herpétiques ne sont d’aucune utilité.
Prise en charge
En cas de primo-infection maternelle ou de récurrence pendant la grossesse, la prévention de la transmission à l’enfant repose sur un traitement maternel par aciclovir ou valaciclovir, associé une désinfection oculaire chez le nouveau-né (aciclovir en collyre).
Une césarienne est recommandée en cas de lésions herpétiques maternelles au début du travail, et discutée en cas de primo-infection datant de moins de 1 mois ou de récurrence datant de moins de 1 semaine avant l’accouchement.
En cas de suspicion d’herpès néonatal, la gravité et les risques élevés de mortalité ou de séquelles neurologiques imposent d’instaurer un traitement précoce par aciclovir IV sans attendre la confirmation virologique.
Herpès maternel à risque : primo-infection < 1 mois, récurrence < 1 semaine avant l’accouchement.
Herpès néonatal clinique ou simple suspicion : aciclovir IV en urgence chez le nouveau-né.
3. Sérologies VHB, VIH positives chez la mère
Sérologie VHB positive
Environ 1 % des femmes enceintes sont atteintes d’hépatite B.
Le dépistage (recherche d’antigènes HBs) est obligatoire au 6e mois de grossesse.
La transmission à l’enfant survient à l’accouchement essentiellement (contact avec du sang maternel). Il n’y a pas d’embryofœtopathie. En cas d’infection, 80 à 90 % des nouveau-nés développent une hépatite B chronique.
Ce n’est pas une cause d’ictère néonatal, compte tenu du délai d’incubation de l’hépatite B.
Le risque de transmission à l’enfant, élevé en l’absence de mesures préventives, est augmenté en cas de positivité de l’antigène HBe avec ADN VHB détectable chez la mère.
La prévention de la transmission à l’enfant repose sur une sérovaccination dès la naissance, avant H12 de vie : administration intramusculaire d’immunoglobulines anti-HBs et 1re dose de vaccin contre le VHB. Le schéma vaccinal doit ensuite être poursuivi, avec une injection à 1 et 6 mois de vie. L’efficacité de ces mesures de prévention doit être évaluée par la recherche de l’antigène HBs et le titrage des anticorps anti-HBs à partir de l’âge de 9 mois, et si possible 1 à 4 mois après la dernière dose vaccinale.
Le VHB est excrété dans le lait maternel mais l’allaitement maternel est autorisé après sérovaccination car l’enfant est protégé.
Sérologie VIH positive
Environ 1 400 grossesses par an de femmes vivant avec le VIH sont menées à terme en France. Le dépistage du VIH chez la femme enceinte n’est pas obligatoire, mais systématiquement proposé lors de la première consultation obstétricale ainsi qu’au troisième trimestre de grossesse en cas de facteur de risque et/ou si une autre IST coexiste.
Cette situation expose le nouveau-né au risque de contamination, notamment en fin de grossesse et surtout au cours de l’accouchement en l’absence de traitement antirétroviral de la mère. La transmission est possible au cours de l’allaitement maternel. Il n’y a pas d’embryofœtopathie.
Le traitement préventif de la transmission mère-enfant (PTME) a pour objectif d’éviter la transmission du VIH. Un traitement antirétroviral pendant toute la durée de la grossesse permet un contrôle précoce de la charge virale maternelle, qui doit être indétectable au moment de l’accouchement. Le risque global de transmission mère-enfant du VIH-1 est de 0,6 % lorsque la charge virale maternelle à l’accouchement est inférieure à 50 copies/ml. Plus le traitement est débuté précocement, plus ce risque est faible. Il est à 0 % quand la mère est traitée depuis la conception.
La PTME est poursuivie chez le nouveau-né par un traitement prophylactique postnatal comportant de la névirapine per os pendant 15 jours. Certaines situations à risque de transmission mère-enfant élevé (absence de traitement maternel durant la grossesse, charge virale élevée de la mère à l’accouchement, durée de traitement courte pendant la grossesse) peuvent nécessiter un traitement prophylactique postnatal renforcé (trithérapie).
L’allaitement maternel n’est jusqu’à présent pas recommandé en France. Cette recommandation est amenée à évoluer dans certaines situations de faible risque d’infection et de possibilité d’un suivi étroit.
L’absence d’infection par le VIH est confirmée si deux prélèvements (charge virale ARN VIH plasmatique) sont négatifs en dehors de la période de prophylaxie, en général observée vers l’âge de 3 mois.
Le calendrier vaccinal est débuté sans délai dans les premiers mois de vie, à l’exception du BCG (vaccin vivant) qui doit être reporté jusqu’à confirmation de l’absence d’infection.
VHB : sérovaccination contre l’hépatite B dès la naissance.
VIH : névirapine prophylactique dès la naissance.
4. Séroconversions maternelles pendant la grossesse
Toxoplasmose
Près de 50 % des femmes enceintes ne sont pas immunisées contre la toxoplasmose.
Environ 1 à 2 % font une primo-infection au cours de la grossesse. Celle-ci expose l’enfant au risque de toxoplasmose congénitale par passage transplacentaire de Toxoplasma gondii. L’atteinte fœtale est d’autant plus sévère que la primo-infection est précoce (premier trimestre : tératogenèse, avortement spontané), mais d’autant plus fréquente que la primo-infection est tardive.
La toxoplasmose congénitale se manifeste par une atteinte neuro-oculaire prédominante (microcéphalie, hydrocéphalie obstructive, calcifications intracrâniennes, choriorétinite). Elle peut être asymptomatique (et diagnostiquée au fond d’œil et à l’échographie transfontanellaire à la naissance).
Le dépistage du statut sérologique est obligatoire lors de la première consultation prénatale, puis tous les mois jusqu’à l’accouchement en cas de sérologie négative.
Des recommandations hygiéno-diététiques (consommation de viande bien cuite, lavage des légumes et fruits consommés crus, éviction du contact avec les chats) sont proposées pour limiter le risque de séroconversion. Il n’existe pas de vaccin contre la toxoplasmose.
La prise en charge en cas de primo-infection maternelle confirmée (séroconversion) repose actuellement sur le traitement prophylactique systématique de la mère par spiramycine en attendant les résultats du diagnostic de contamination fœtale (efficacité contestée).
Le diagnostic d’atteinte fœtale est possible par amniocentèse à partir de 18 SA et 4 semaines après la date d’infection maternelle, estimée à mi-temps entre la dernière sérologie négative et la première positive et seulement si la séroconversion est confirmée avec apparition d’IgG spécifiques.
En cas de toxoplasmose congénitale prouvée (amniocentèse positive), la spiramycine est remplacée par un traitement parasiticide (pyriméthamine et sulfadiazine associées à de l’acide folinique), poursuivi jusqu’à l’accouchement. Un suivi échographique bimensuel permet de déceler les signes de fœtopathie dont la présence fait discuter une interruption médicale de grossesse. Si la grossesse est poursuivie, le nouveau-né doit recevoir un traitement curatif pendant au moins 1 an.
En l’absence de preuve de toxoplasmose congénitale (amniocentèse négative), le traitement prophylactique maternel est maintenu jusqu’à la fin de la grossesse (risque de faux négatifs de l’amniocentèse), avec un suivi échographique mensuel.
Dans tous les cas, un suivi postnatal (neurologique, ophtalmologique) est indispensable.
Rougeole
La survenue d’une rougeole chez une femme enceinte expose à une rougeole congénitale, pouvant être sévère, avec une mortalité néonatale qui était élevée avant la généralisation des immunoglobulines et l’usage des antibiotiques (pneumopathies bactériennes de surinfection).
Elle est associée à un risque accru de panencéphalite subaiguë sclérosante de survenue précoce (avant 2 ans) et d’évolution fulminante. Le risque de rougeole congénitale est maximal quand l’éruption maternelle survient dans les 10 jours précédant l’accouchement.
Chez le nouveau-né, la prévention de la rougeole congénitale et de ses complications repose sur l’administration d’immunoglobulines polyvalentes intraveineuses dès la naissance, sauf si la mère a débuté son éruption rougeoleuse plus de 10 jours avant l’accouchement.
Rubéole
Environ 10 % des femmes enceintes ne sont pas immunisées contre la rubéole. On compte moins de 40 cas par an en France de rubéole pendant la grossesse.
Le dépistage du statut sérologique de toute femme enceinte est obligatoire lors de la première consultation, avec un contrôle vers 20 SA en cas de sérologie négative.
Le risque d’atteinte fœtale par passage viral transplacentaire est important en cas de rubéole maternelle avant 18 SA.
La rubéole congénitale est une embryofœtopathie associant un RCIU et une atteinte neurosensorielle (surdité, microcéphalie, retard psychomoteur), cardiaque (malformations) et oculaire (microphtalmie, cataracte, rétinite).
En cas de séroconversion maternelle, le diagnostic anténatal de rubéole congénitale par amniocentèse au moins 4 semaines après la séroconversion est possible.
Il n’existe pas de traitement. Seule une surveillance échographique mensuelle à la recherche d’anomalies évocatrices est mise en place.
Une atteinte fœtale peut faire l’objet d’une autorisation d’IMG.
La prévention repose sur la vaccination des femmes non immunisées en âge de procréer et celle des enfants dans le cadre du calendrier vaccinal. Une femme enceinte séronégative devra être vaccinée en post-partum (le vaccin vivant atténué est contre-indiqué au cours de la grossesse).
CMV
Une infection congénitale à CMV après séroconversion maternelle concerne 0,7 % des naissances vivantes.
Le dépistage du statut sérologique n’est pas obligatoire.
Environ 15 à 20 % des enfants infectés développent des séquelles neurodéveloppementales à long terme, avec notamment un risque de surdité (voir chapitre 4) et de déficit cognitif. Une séroconversion en périconceptionnel ou pendant le premier trimestre et la présence d’anomalies cérébrales sévères à l’échographie anténatale sont de mauvais pronostic.
Le suivi postnatal des enfants atteints est prolongé (neurodéveloppement, audition) ; un traitement par valganciclovir est indiqué dans certains cas.
Varicelle
Environ 5 % des femmes enceintes ne sont pas immunisées contre la varicelle. On compte environ 700 cas par an en France de varicelle en cours de grossesse.
Le dépistage du statut sérologique n’est pas obligatoire.
Le diagnostic de varicelle maternelle est posé devant une éruption vésiculeuse prurigineuse avec éléments d’âges différents (voir chapitre 38).
Le risque pour le fœtus dépend du terme à la primo-infection maternelle. Avant 20 SA, le risque est celui d’une varicelle congénitale (2 %), de pronostic sévère, associant un RCIU et une atteinte cutanée, oculaire, neurologique et squelettique. Après 20 SA, le risque d’embryofœtopathie est faible.
En cas de varicelle maternelle en fin de grossesse, dans les 5 jours précédant ou les 3 jours suivant l’accouchement, le risque est celui d’une varicelle néonatale, mortelle dans 20 à 30 % des cas. Celle-ci, survenant entre le 5e et le 10e jour de vie, associe une éruption cutanée généralisée, volontiers ulcéronécrotique ou hémorragique, et une atteinte pulmonaire et neurologique (méningo-encéphalite).
La prise en charge d’une femme enceinte en contact avec un sujet varicelleux repose sur la vérification de son statut immunitaire (anamnèse, IgG anti-varicelle).
En cas de séronégativité, l’administration IV d’immunoglobulines spécifiques anti-VZV est recommandée. La vaccination contre VZV est contre-indiquée chez la femme enceinte.
En cas de varicelle maternelle survenant entre 5 jours avant l’accouchement et 2 jours après celui-ci, la prophylaxie de la varicelle chez le nouveau-né repose sur l’administration IV d’immunoglobulines spécifiques anti-VZV et un traitement par aciclovir IV.
Toxoplasme et rubéole : suivi sérologique en cas de séronégativité maternelle.
Varicelle maternelle per-partum : administration d’immunoglobulines anti-VZV chez la mère et traitement du nouveau-né par immunoglobulines anti-VZV et aciclovir IV en prophylaxie.
D. Infections bactériennes néonatales
1. Définitions
Anciennement dénommées infections maternofœtales (IMF), les infections néonatales bactériennes précoces (INBP) consistent en une transmission verticale de l’infection bactérienne entre la mère et son enfant. Elles sont le plus souvent prénatales. La contamination se fait rarement par voie hématogène transplacentaire (Listeria). Les INBP sont le plus souvent d’origine ascendante à partir des voies génitales colonisées par un agent infectieux pathogène, avec ou sans rupture de la poche des eaux, et souvent associées à des lésions de chorioamniotite clinique et/ou histologique. Elles surviennent dans les 7 premiers jours de vie, le plus souvent dans les 48 premières heures. Les deux bactéries les plus fréquents des INBP sont le streptocoque du groupe B (Streptococcus agalactiae, SGB) et Escherichia coli.
2. Diagnostic d’infection néonatale bactérienne précoce
Enquête clinique
Données anamnestiques
Les informations concernant la grossesse ou l’accouchement sont essentielles.
Le dépistage systématique du portage vaginal de SGB (prévalence d’environ 10 %) est recommandé à partir du terme de 34 SA.
Les facteurs de risque anténatals associés à une augmentation du risque de développer une INBP sont :
• un antécédent d’infection néonatale à SGB lors d’une précédente grossesse ;
• une colonisation maternelle à SGB durant la grossesse actuelle (PV de dépistage de SGB positif soit par culture, soit par PCR rapide en per-partum, et/ou bactériurie à SGB) ;
• la prématurité (dès < 37 SA) ;
• la rupture prolongée des membranes amniotiques (dès 12 heures de rupture) ;
• la fièvre maternelle > 38 °C en per-partum ou dans les 2 heures suivant l’accouchement (marqueur indirect de chorioamniotite dont la définition n’est pas consensuelle selon qu’il s’agit d’une définition clinique, microbiologique ou histologique).
Une antibioprophylaxie maternelle per-partum est recommandée dans les situations précédentes.
Le pédiatre doit s’assurer des indications et du caractère adéquat de cette antibioprophylaxie per-partum (ou de l’antibiothérapie maternelle) afin d’apprécier le niveau de risque d’INBP.
Les critères d’une antibioprophylaxie per-partum adéquate sont les suivants : l’antibiothérapie maternelle doit avoir été administrée par voie parentérale (IV), plus de 4 heures avant la naissance, en utilisant la pénicilline G, l’ampicilline ou l’amoxicilline, ou la céfazoline.
En cas d’antibioprophylaxie per-partum inadéquate ou de fièvre maternelle per-partum ou dans les 2 heures après l’accouchement, le nouveau-né doit bénéficier d’une surveillance clinique spécifique de 48 heures en maternité.
Évaluation clinique
Il n’existe pas de signe clinique spécifique de l’INBP, ce qui constitue une difficulté diagnostique majeure. Les symptômes possibles sont nombreux, mais rarement tous réunis. Chacun d’entre eux doit attirer l’attention, en particulier la fièvre qui ne doit jamais être banalisée à cet âge.
Signes cliniques pouvant faire évoquer une INBP :
- signes généraux : fièvre (température ≥ 38 °C) ou hypothermie (température < 36 °C) ;
- signes respiratoires : détresse respiratoire (geignement, battement des ailes du nez, signes de rétraction) et tachypnée (FR > 60/min) d’emblée ou qui apparaissent après 4 heures de vie, apnée ;
- signes hémodynamiques : tachycardie (> 160 bpm) ou bradycardie (< 100 bpm), signes de choc (augmentation du TRC, pâleur, hypotension artérielle, oligurie) ;
- signes neurologiques : somnolence, irritabilité, hypotonie, convulsions ;
- signes digestifs : refus de boire, vomissements
La majorité de ces signes cliniques ne sont pas spécifiques d’une infection, néanmoins leur présence dans les 48 premières heures de vie doit faire évoquer une INBP.
Le sepsis néonatal ne constitue pas la présentation clinique la plus fréquente de l’INBP. Il est défini par la présence d’au moins deux critères parmi les quatre suivants :
- température > 38,5 °C ou < 36,0 °C ;
- tachycardie (> 180/min) ou bradycardie (< 100/min) ;
- FR > 50/min ou nécessité de ventilation mécanique ;
- leucocytose > 34 000/mm3.
Parmi les deux critères retenus, un doit être la température anormale ou l’hyperleucocytose.
Enquête paraclinique
Le diagnostic de certitude repose sur l’identification d’une bactérie pathogène dans le sang (hémoculture) ou le LCS.
La réalisation d’une hémoculture est recommandée pour tout nouveau-né qui présente des signes cliniques d’INBP ou de sepsis avant l’instauration d’une antibiothérapie probabiliste. Parce que la sensibilité des hémocultures est médiocre à cet âge, il est recommandé d’ensemencer 2 ml de sang (1 ml minimum) systématiquement avant toute antibiothérapie.
La ponction lombaire est indiquée chez un nouveau-né avec altération de l’état général ou signes cliniques neurologiques ou de sepsis néonatal et dont l’état clinique est compatible avec la réalisation du geste.
Une PL est également indiquée en cas d’hémoculture positive à un germe pathogène ou en cas de réponse partielle ou en l’absence d’amélioration clinique 48 heures après le début du traitement antibiotique.
Les autres examens complémentaires servent à étayer la probabilité d’une infection.
Un dosage de CRP peut être pratiqué à distance de la naissance (H12 ou H24) compte tenu de la cinétique retardée par rapport au début de l’infection. L’intérêt de la procalcitonine dosée au sang du cordon est en cours d’évaluation.
La réalisation d’une NFS n’est plus recommandée systématiquement du fait de sa valeur diagnostique médiocre.
L’ECBU n’est pas utile dans les premiers jours de vie mais uniquement en cas de suspicion d’infection néonatale bactérienne tardive (après J7).
Les prélèvements périphériques (gastriques et orificiels) ne sont plus recommandés.
3. Prise en charge en cas de suspicion d’INBP
Quand l’enfant est symptomatique, une antibiothérapie probabiliste par voie IV doit être administrée en urgence (dans l’heure) après bilan clinique, biologique et bactériologique.
Si un nouveau-né est asymptomatique, les indications d’antibiothérapie doivent être exceptionnelles. Ces nouveau-nés doivent faire l’objet d’une surveillance clinique codifiée et adaptée à leur niveau de risque infectieux en maternité.
L’infection bactérienne néonatale doit être suspectée sur des critères cliniques, éventuellement confortée par certaines données biologiques (CRP) et affirmée par les examens bactériologiques les plus utiles.
E. Détresses respiratoires
1. Caractériser la détresse respiratoire
Signes à rechercher chez le nouveau-né :
- polypnée : FR > 60/min ;
- signes de lutte respiratoire : intensité appréciée par le score de Silverman (tableau 44.6) ;
- cyanose : généralisée, intense ou modérée (en général reconnue pour une SpO2 < 85 %) ; une cyanose réfractaire, sans détresse respiratoire associée, doit faire évoquer soit une cardiopathie cyanogène soit une hypertension pulmonaire ;
- signes de gravité : pauses respiratoires (épuisement), troubles hémodynamiques.
Tableau 44.6. ![]() Score de Silverman.
Score de Silverman.
| Critères | 0 | 1 | 2 |
|---|---|---|---|
| Battement des ailes du nez (BAN) | Absent | Modéré | Intense |
| Balancement thoraco-abdominal (BTA) | Soulèvement synchrone | Thorax immobile | Respiration paradoxale |
| Tirage intercostal (TIC) | Absent | Modéré | Intense |
| Entonnoir xiphoïdien | Absent | Modéré | Intense |
| Geignement expiratoire | Absent | Audible au stéthoscope | Audible à l’oreille |
Marc B, et al., Fiche 205 – Score de Silverman. In: Guide infirmier des urgences. 2008, Page 732 © Elsevier Masson.
Score de Silverman (nouveau-né) : BAN, BAT, TIC, entonnoir xiphoïdien, geignement expiratoire.
2. Synthèse des causes médicales de détresse respiratoire
Elle est proposée dans le tableau 44.7.
Tableau 44.7. ![]()
![]() Synthèse des principales causes médicales de détresse respiratoire.
Synthèse des principales causes médicales de détresse respiratoire.
| Retard de résorption du liquide pulmonaire | Inhalation méconiale | Infection néonatale | Maladie des membranes hyalines (MMH) | |
|---|---|---|---|---|
| Contexte | Césarienne (surtout avant travail) | Nouveau-né à terme ou post-terme Liquide amniotique méconial Asphyxie périnatale |
Facteurs de risque d’INBP | Prématurité (< 32 SA) Absence de corticothérapie anténatale Parfois diabète maternel |
| Clinique | Détresse respiratoire immédiate s’améliorant progressivement en quelques heures Polypnée prédominante |
Détresse respiratoire immédiate, d’évolution potentiellement grave | Non spécifique | Détresse respiratoire apparue très rapidement après la naissance et d’aggravation progressive |
| Radio du thorax | Syndrome interstitiel Scissurite Épanchement interlobaire |
Opacités alvéolaires grossières, asymétriques Troubles de ventilation |
± Opacités alvéolaires irrégulières | Syndrome alvéolaire bilatéral |
| Gaz du sang | Normaux | Hypoxie, hypercapnie | Variables | Hypoxie, hypercapnie |
| Traitement | PEP par canules nasales Rarement ventilation mécanique avec PEP |
Ventilation mécanique avec PEP | Antibiothérapie Soutien ventilatoire adapté |
Surfactant exogène Ventilation non invasive (PEP) de préférence ; ventilation mécanique parfois nécessaire |
| Pronostic | Excellent | Celui de l’asphyxie périnatale | Celui de l’infection | Celui de la prématurité Dysplasie bronchopulmonaire |
PEP : pression expiratoire positive
Trois causes principales de détresse respiratoire néonatale : retard de résorption du liquide pulmonaire, maladie des membranes hyalines, inhalation de liquide amniotique méconial.
Toujours évoquer une infection.
Références

|
Calendrier des vaccinations et recommandations vaccinales 2023. https://sante.gouv.fr/IMG/pdf/calendrier_vaccinal_maj-juin23.pdf Nouvelle version à rechercher chaque année sur le site du ministère. |

|
HAS, SFN. Infections néonatales bactériennes précoces (INBP). 2017. https://www.sfpediatrie.com/sites/www.sfpediatrie.com/files/documents/l… |
|

|
HAS. Avis n° 2022.0060/AC/SESPEV du 10 novembre 2022 du Collège de la Haute Autorité de santé relatif à la généralisation du dépistage de la drépanocytose en France métropolitaine. https://has-sante.fr/upload/docs/application/pdf/2022-11/avis_n2022.0060_ac_sespev_du_10_novembre_2022_du_college_has_relatif_a_la_generalisation_du_depistage_de_la_ drepanocytose_en.pdf |

|
Ministère de la Santé et de la Prévention. Programme national de dépistage néonatal. Détecter et prendre en charge précocement 13 maladies graves de l’enfant. https://sante.gouv.fr/soins-et-maladies/prises-en-charge-specialisees/maladies-rares/DNN |
