Objectifs pédagogiques
- Connaître la prévalence et les agents infectieux.
- Diagnostiquer les complications et connaître les critères d’hospitalisation ainsi que les traitements des bronchites aiguës, des bronchiolites des exacerbations de BPCO et des pneumonies communautaires.
- Connaître le traitement de la pneumonie à pneumocoque.
Avant de commencer…
La suspicion du diagnostic de pneumonie aiguë est clinique.
Le diagnostic est confirmé par l’imagerie (radiographie, échographie).
L’approche étiologique et thérapeutique des pneumonies communautaires est probabiliste.
Les streptocoques (pneumocoque et streptocoque du groupe A) restent les germes à redouter à tout âge.
Les situations d’urgence sont liées à la sévérité de la détresse respiratoire aiguë.
Le suivi immédiat est relié à l’évolution des signes infectieux et respiratoires.
La conduite à tenir en cas d’échec thérapeutique à 48–72 heures doit être connue.
Les pleurésies purulentes sont la complication évolutive la plus fréquente chez l’enfant.
I. Pour bien comprendre
A. Préambule
Le terme de pneumopathie traduit une pathologie pulmonaire, pas forcément d’origine infectieuse, par exemple : pneumopathie d’inhalation, pneumopathie interstitielle, pneumopathie d’hypersensibilité.
Les pneumonies aiguës traduisent une atteinte infectieuse du parenchyme pulmonaire.
Le qualificatif de « communautaires » concerne les infections acquises en ambulatoire, par opposition au terme de « nosocomiales » définissant celles acquises en milieu hospitalier.
Les pneumonies aiguës de l’enfant se caractérisent par plusieurs points forts :
- la possibilité de tableaux cliniques atypiques avec des signes extrathoraciques parfois au premier plan : douleurs abdominales, syndrome pseudo-méningé ;
- la grande fréquence des pneumonies virales, notamment chez le jeune enfant ;
- la nécessité d’évoquer la responsabilité possible du pneumocoque à tout âge ;
- la responsabilité possible de Mycoplasma pneumoniae après 3 ans, et surtout après 5 ans ;
- l’absence d’indication habituelle des fluoroquinolones.
B. Épidémiologie
1. Prévalence
Les pneumonies aiguës représentent une cause majeure de mortalité chez les enfants âgés de moins de 5 ans dans les pays en développement (près de 800 000 décès par an).
Les données épidémiologiques sont à évaluer selon l’âge de l’enfant et le pays. En France, la majorité des pneumonies ou des pleuropneumopathies à pneumocoque de l’enfant survient avant l’âge de 5 ans.
2. Agents infectieux
Virus à tropisme respiratoire le plus souvent : virus respiratoire syncitial (VRS), virus influenza A et B, virus parainfluenza, métapneumovirus, rhinovirus, adénovirus, coronavirus SARS-CoV-2.
Bactéries :
- avant tout :
- Streptococcus pneumoniae (pneumocoque) : observé à tout âge ;
- Mycoplasma pneumoniae (mycoplasme) : principalement après 3 ans ;
- plus rarement :
- Staphylococcus aureus : pleuropneumopathie bulleuse du nourrisson et pneumonie nécrosante possiblement reliées à la leucocidine de Panton et Valentine ;
- streptocoque hémolytique du groupe A : tableau clinique volontiers sévère ;
- Haemophilus influenzae b : exceptionnellement en cause depuis la généralisation de la vaccination anti-Haemophilus influenzae b.
Co-infections (virus + bactérie ; pneumocoque + mycoplasme) fréquentes.
3. Impact de la vaccination pneumococcique
La vaccination pneumococcique est détaillée dans le chapitre 41.
Il existe deux types de vaccins : vaccin pneumococcique conjugué à 13 valences obligatoire chez le nourrisson depuis janvier 2018 et le vaccin polyosidique 23-valent recommandé (en rappel) après l’âge de 2 ans pour certains terrains à risque.
Aucun de ces vaccins ne contient tous les sérotypes de pneumocoque. Une couverture vaccinale même correcte ne remet donc pas en cause les indications antibiotiques proposées.
Redouter en premier lieu le pneumocoque à tout âge.
II. Diagnostiquer une pneumonie aiguë
A. Diagnostic positif
1. Évocation clinique
L’origine basse d’une infection des voies aériennes est cliniquement évoquée devant l’association :
- d’une fièvre ;
- et d’au moins un des paramètres suivants :
- augmentation de fréquence respiratoire (parfois reliée à la fièvre) ;
- existence de signes de lutte ;
- anomalies à l’auscultation pulmonaire (diminution du murmure vésiculaire, crépitants en foyer, souffle tubaire).
Une toux fébrile isolée n’est pas suffisante pour établir un diagnostic clinique de pneumonie.
L’imagerie du thorax permet d’affirmer le diagnostic.
La prescription systématique d’une radiographie de thorax fait néanmoins débat dans les formes ambulatoires, sans gravité.
Une imagerie du thorax reste indispensable si la présentation clinique initiale n’est pas typique, s’il existe des critères de gravité (voir infra) ou si l’évolution clinique n’est pas favorable.
2. Confirmation radiographique
La radiographie du thorax de face en inspiration est l’imagerie de première intention.
Un cliché de profil est exceptionnellement nécessaire pour le diagnostic des opacités parenchymateuses.
Les images évoquant la pneumonie sont habituellement précoces.
La pneumonie se traduit par une opacité. Il est important de préciser son caractère systématisé ou non, la présence en son sein d’un éventuel bronchogramme aérien (qui permet d’en affirmer la nature alvéolaire), son éventuel caractère rétractile ou expansif (qui devra faire évoquer un autre diagnostic), l’association à des complications (épanchement, abcès), et sa localisation.
La localisation de la pneumonie peut être parfois précisée grâce à des règles simples (fig. 59.1) :
- une opacité de la base droite effaçant le bord droit du cœur mais pas la ligne diaphragmatique droite siège dans le lobe moyen ;
- une opacité de la base droite effaçant la ligne diaphragmatique droite, mais pas le bord droit du cœur siège dans le lobe inférieur droit ;
- une opacité de la base gauche effaçant le bord gauche du cœur mais pas la ligne diaphragmatique gauche siège dans la lingula ;
- une opacité de la base gauche effaçant la ligne diaphragmatique gauche, mais pas le bord gauche du cœur siège dans le lobe inférieur gauche ; elle peut-être entièrement rétrocardiaque et identifiable seulement par la perte de la ligne diaphragmatique.
L’imagerie ne permet pas en revanche de poser un diagnostic étiologique discriminant entre infection virale, bactérienne ou mixte.
L’échographie pulmonaire est un bon examen pour confirmer le diagnostic de pneumonie et identifier des complications comme l’épanchement pleural.
Elle est réalisable en première intention, en ambulatoire ou au lit du malade, non irradiante. Bien que simple à pratiquer, elle nécessite toutefois un apprentissage pour une bonne interprétation.
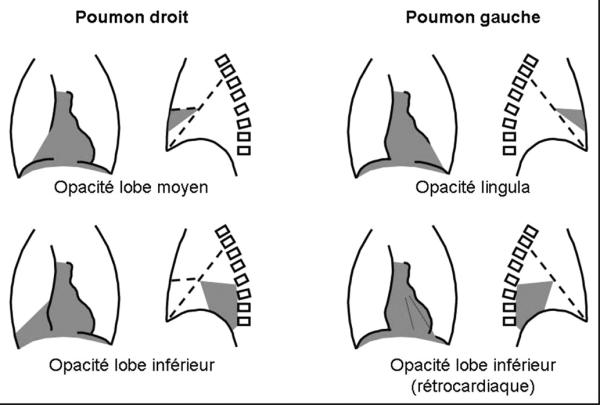
Fig. 59.1. ![]() Localisation de la pneumonie aiguë.
Localisation de la pneumonie aiguë.
Toute toux fébrile n’est pas une pneumonie. Chiffrer la FR.
La confirmation diagnostique de certitude repose sur un cliché thoracique de face.
Un diagnostic différentiel doit être évoqué en cas d’opacité expansive.
B. Appréciation de la gravité
Le tableau 59.1 présente les critères de gravité d’une pneumonie aiguë.
Tableau 59.1. ![]() Critères de gravité d’une pneumonie aiguë
Critères de gravité d’une pneumonie aiguë
| Terrain |
|
| Sévérité clinique |
|
Retenir : terrain, dyspnée à la prise des biberons, oxygénodépendance, pneumopathie étendue.
C. Orientation étiologique
1. Principaux germes
Certains arguments cliniques et radiographiques peuvent orienter le diagnostic étiologique. Ils ne sont proposés qu’à titre de « repères » pour les trois principaux agents infectieux en cause (tableau 59.2).
Radiologiquement, les foyers de condensation segmentaire ou lobaire sont évocateurs mais non spécifiques d’une pneumonie à pneumocoque (fig. 59.2). Un syndrome interstitiel peut orienter vers une pneumonie à mycoplasme. Les pneumonies rondes (fig. 59.3) sont particulières à l’enfant.
Tableau 59.2. ![]() Orientation étiologique des pneumonies aiguës.
Orientation étiologique des pneumonies aiguës.
| Virus | Pneumocoque | Mycoplasme | |
|---|---|---|---|
| Âge | Tout âge | Tout âge | > 3 ans |
| Contexte | Épidémique | Sporadique | Épidémique |
| Mode de début | Progressif | Brutal | Progressif |
| Fièvre | ++ | +++ | + |
| Signes respiratoires | Rhinopharyngite, toux Ronchus ± sibilants Pas de foyer auscultatoire |
Toux parfois différée Douleur thoracique Foyer auscultatoire |
Toux sèche durable ± Foyer auscultatoire |
| Signes associés | État général conservé Diarrhée Éruption, myalgies |
Altération de l’état général Tableau pseudo-appendiculaire Signes pseudo-méningés |
État général conservé Éruption, érythème polymorphe Myalgies Conjonctivite |
| Tolérance clinique | Bonne | Mauvaise | Souvent bonne |
| Radiologie | Opacités mal limitées et bilatérales | Opacité systématisée habituellement unilobaire et avec bronchogramme aérien | Opacités mal limitées et bilatérales |
| Biologie | Syndrome inflammatoire absent ou modéré | Syndrome inflammatoire franc | Syndrome inflammatoire modéré |
Fig. 59.2. ![]() Pneumonie franche lobaire aiguë droite.
Pneumonie franche lobaire aiguë droite.
Radiographie du thorax de face. Opacité parenchymateuse droite.
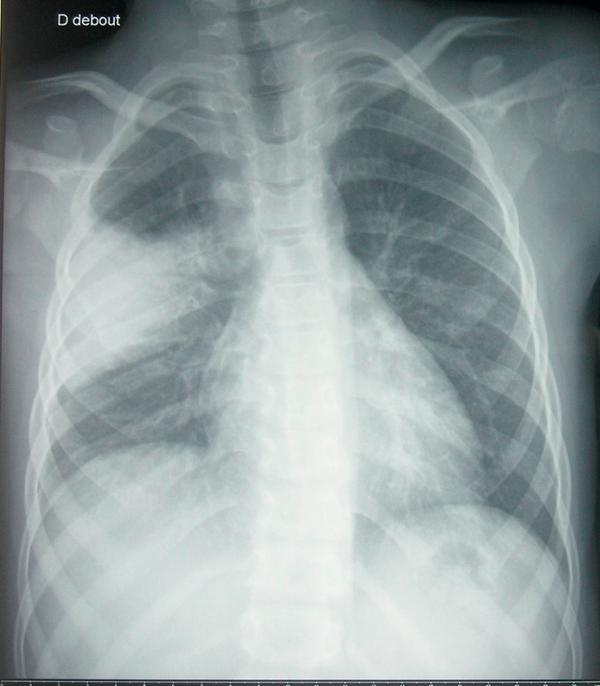
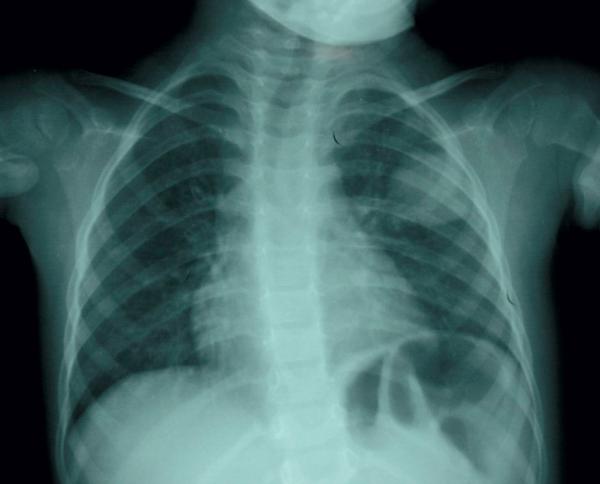
Fig. 59.3. ![]() Pneumonie ronde.
Pneumonie ronde.
Radiographie du thorax de face. Opacité ronde.
2. Staphylococcie pleuropulmonaire du nourrisson
C’est une infection rare mais nécessitant une prise en charge urgente.
Le germe en cause est Staphylococcus aureus.
La porte d’entrée est avant tout respiratoire, parfois par voie hématogène à point de départ cutané. En cas d’allaitement au sein, un abcès mammaire doit être recherché.
Le tableau clinique n’est pas spécifique mais volontiers sévère.
Il existe fréquemment des signes de détresse respiratoire et des signes généraux marqués témoignant souvent d’un sepsis grave (tachycardie, TRC allongé). Les signes digestifs peuvent être au premier plan notamment chez le jeune nourrisson avec un météorisme abdominal « pseudo-occlusif ».
Radiologiquement, des images bulleuses doivent faire suspecter ce diagnostic (fig. 59.4).
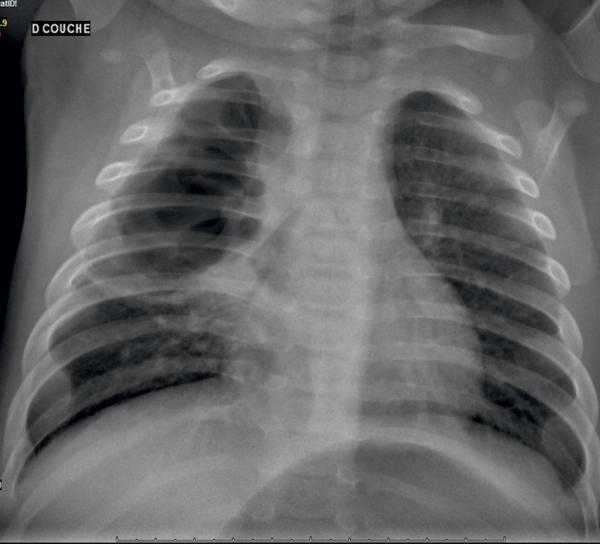
Fig. 59.4. ![]() Pleuropneumopathie à S. aureus.
Pleuropneumopathie à S. aureus.
Radiographie du thorax de face. Staphylococcie pleuropulmonaire droite : bulles apicales droites, refoulement de la petite scissure vers le bas, médiastin en place.
D. Enquête paraclinique
1. Généralités
La radiographie du thorax (ou l’échographie thoracique dans certains centres) permet la confirmation diagnostique.
Les marqueurs inflammatoires (CRP ou PCT) lorsqu’ils sont élevés, peuvent conforter le clinicien dans son hypothèse d’infection bactérienne devant une pneumonie. Toutefois, ils n’ont pas fait la preuve à ce jour d’une fiabilité suffisante au sein d’algorithmes décisionnels de prise en charge ambulatoire des pneumonies de l’enfant. Ils ne sont donc pas nécessaires à l’initiation d’une antibiothérapie devant une pneumonie aigüe fébrile de l’enfant sans signe de sévérité.
L’antibiothérapie ne doit pas être différée. Elle demeure aujourd’hui initialement probabiliste, adaptée selon l’âge, le contexte clinique et les données épidémiologiques bactériennes du pays. En pratique, il est d’usage de traiter en première intention par antibiotique (amoxicilline) les pneumonies aiguës de l’enfant pour couvrir le pneumocoque, principal agent responsable des infections sévères en milieu communautaire. Les examens paracliniques autres que l’imagerie (hémoculture, marqueurs inflammatoires…) sont en revanche nécessaires en cas de formes sévères justifiant d’une prise en charge hospitalière.
2. Autres examens paracliniques chez un enfant hospitalisé pour pneumonie
Examens biologiques
NFS, CRP ou PCT permettent d’apprécier le syndrome infectieux biologique. Leur répétition au cours de l’évolution est intéressante pour juger de l’efficacité thérapeutique.
D’autres anomalies biologiques peuvent être vues. Le mycoplasme peut s’accompagner d’une anémie hémolytique. Exceptionnellement, anémie et thrombopénie peuvent être présentes, secondaires à un SHU post-pneumococcique.
L’ionogramme sanguin peut parfois montrer des conséquences de troubles digestifs, un possible SIADH associé au pneumocoque (hyponatrémie), ou exceptionnellement une insuffisance rénale par SHU post-pneumococcique.
Examens microbiologiques
En cas de pneumonie aiguë :
- hémoculture : systématique dans les formes sévères (sensibilité < 10 %) ;
- recherches virales par test antigénique ou PCR sur sécrétions nasopharyngées (surtout chez le nourrisson) : intérêt uniquement si modification attendue de la prise en charge (abstention d’antibiothérapie et/ou traitement antiviral précoce en cas de diagnostic de grippe, par exemple) ;
- recherche d’antigène pneumococcique dans les urines (test BinaxNOW®) : non recommandée chez l’enfant < 5 ans, du fait de faux positifs fréquents liés au portage pharyngé de pneumocoque ; utile chez le plus âgé dans les formes sévères.
En cas d’épanchement pleural :
- ponction pleurale systématique, au mieux après repérage échographique, avec examen direct et culture ;
- recherche d’antigène pneumococcique sur liquide pleural : excellentes VPN et VPP ; confirmation possible par PCR pneumocoque lorsque la culture reste négative ;
- PCR d’ADNr 16S sur liquide pleural, augmentant la sensibilité de la culture pour une identification d’autres bactéries (à faire si culture négative).
E. Autres diagnostics
Il s’agit des diagnostics différentiels d’opacités radiologiques en climat fébrile.
Éléments sémiologiques devant attirer l’attention :
- opacité expansive, refoulant les organes de voisinage, et sans bronchogramme aérien, orientant vers un processus tumoral ou malformatif ;
- images aériques multiples au sein de l’opacité, faisant évoquer un processus malformatif ;
- antécédent récent de pneumopathie au même site, ou absence de guérison de l’épisode actuel, faisant évoquer un processus malformatif ou une obstruction endobronchique (corps étranger notamment).
F. Complications
1. Épanchement pleural
Diagnostic
Il est le plus souvent unilatéral :
- soit inflammation pleurale réactionnelle avec exsudat stérile ;
- soit infection pleurale avec épanchement purulent riche en bactéries.
Suspicion clinique :
- fièvre persistante malgré l’antibiothérapie initiale ;
- douleur thoracique ;
- immobilité d’un hémithorax ;
- diminution ou abolition du murmure vésiculaire du côté de l’épanchement ;
- matité du côté de l’épanchement ;
Confirmation radiographique (fig. 59.5) :
- opacité effaçant l’ensemble des lignes de voisinage (parfois limitée à un comblement d’un cul-de-sac pleural) ;
- ligne pleurale surnuméraire témoignant de l’épaississement pleural ;
- classique ligne de Damoiseau lorsque l’épanchement n’est pas cloisonné.
Échographie pleurale utile en complément du cliché thoracique (fig. 59.6) :
- évaluation quantitative du volume de l’épanchement (épaisseur) ;
- identification de l’existence de cloisons parfois précoce (pneumocoque) ;
- repérage initial avant ponction.
Scanner thoracique (injecté) réservé à certaines situations :
- évaluation des parts respectives de l’atteinte pleurale et des lésions parenchymateuses ;
- élimination d’un diagnostic différentiel ;
- guide pour la mise en place éventuelle d’un drain.
Ponction pleurale
Elle s’impose devant tout épanchement pleural fébrile.
Les analyses à faire sur le liquide pleural sont : biochimie (protides, glucose, LDH, pH), cytologie (numération cellulaire et formule), anatomopathologie (recherche de cellules anormales), bactériologie (examen direct, cultures, antigènes pneumococciques, PCR).
Fig. 59.5. ![]() Infection pleuropulmonaire.
Infection pleuropulmonaire.
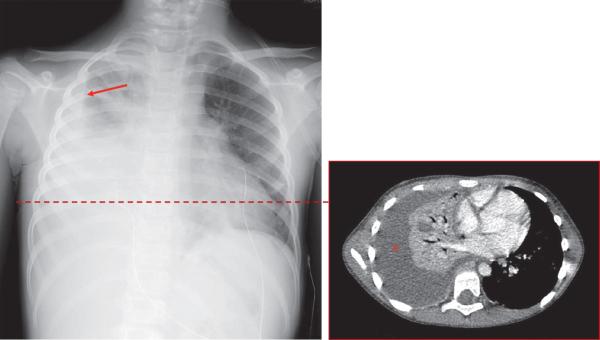
A. Radiographie de thorax de face. Opacité basale droite effaçant à la fois le bord droit du cœur et la coupole diaphragmatique droite. Ligne bordante pleurale droite (flèche) confirmant la présence de liquide.
B. TDM thoracique. Coupe axiale de l’opacité basale droite (ligne pointillée), confirmant une composante pleurale liquidienne (*) et une opacité parenchymateuse alvéolaire.
Fig. 59.6. ![]() Échographie thoracique d’un épanchement pleural cloisonné.
Échographie thoracique d’un épanchement pleural cloisonné.
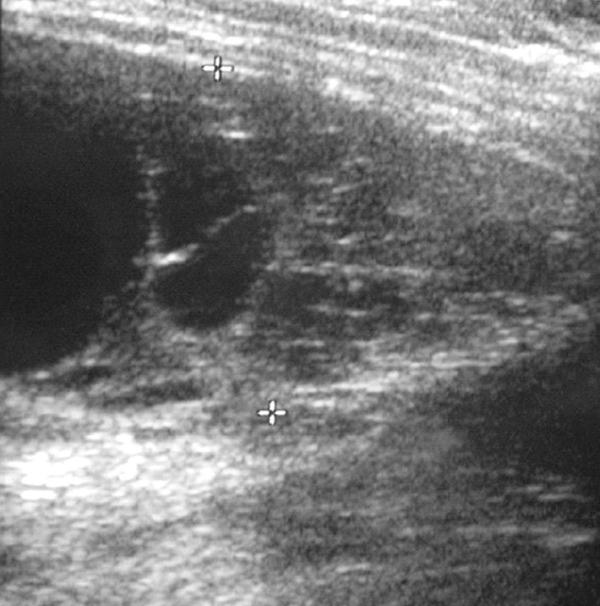
Dans le cadre d’un épanchement d’origine infectieuse, l’analyse montre un exsudat défini par des protides dans le liquide pleural > 35 g/l ou, si les protides pleuraux sont entre 25 à 35 g/l, par 1 des 3 critères de Light : taux protides pleural/protides sérique > 0,5 ou taux LDH pleural/LDH sérique > 0,6 ou LDH pleural > 2/3 de la limite supérieure normale du plasma. L’épanchement réactionnel est d’aspect citrin, sans germe au direct ou à la culture. Le caractère purulent est affirmé sur au moins l’un des critères suivants : aspect macroscopique purulent, glucose dans le liquide pleural < 0,4 g/l, LDH pleural > 1 000 U/l, présence de bactéries. La présence d’une lymphocytose pleurale doit faire évoquer d’autres diagnostics : tuberculose, lymphome.
Hémoculture systématique chez un enfant hospitalisé pour pneumonie aiguë.
Ponction pleurale avec recherche bactériologique indispensable en cas d’épanchement.
2. Abcès
Il témoigne d’une nécrose tissulaire induite par l’infection.
Il est suspecté par la persistance de la fièvre malgré l’antibiothérapie initiale.
Il est confirmé par la radiographie de thorax : image aérique à paroi épaisse et irrégulière, avec ou sans niveau horizontal liquidien.
Une évaluation spécialisée est indispensable.
III. Argumenter l’attitude thérapeutique et planifier le suivi de l’enfant
A. Orientation
Critères d’hospitalisation :
- terrain à risque (voir tableau 59.1), l’âge étant un critère relatif en fonction du contexte et des signes associés (hors période néonatale) ;
- sévérité clinique (voir tableau 59.1) ;
- capacités de surveillance limitées de l’entourage.
En l’absence de ces critères, un traitement ambulatoire peut être proposé.
Le médecin doit néanmoins dispenser à la famille une information précise sur l’histoire naturelle de la maladie, et s’assurer de la bonne compréhension des signes d’aggravation devant conduire à une nouvelle consultation médicale urgente (libérale ou hospitalière).
Aucun isolement n’est recommandé en cas de pneumonie bactérienne communautaire.
En pratique, la fréquence des co-infections virales rend nécessaire un isolement de type respiratoire chez les enfants hospitalisés.
B. Prise en charge thérapeutique
1. Antibiothérapie
Rationnel
Du fait de la difficulté d’éliminer la responsabilité d’une étiologie bactérienne, une antibiothérapie probabiliste est justifiée pour tout diagnostic de pneumonie aiguë.
Les profils de résistance aux antibiotiques sont actuellement :
- pour le pneumocoque : disparition quasi complète des souches résistantes à l’amoxicilline, persistance de 30 % de souches résistantes aux macrolides ;
- pour le mycoplasme : résistance naturelle aux bêtalactamines (car absence de paroi bactérienne), sensibilité presque constante aux macrolides.
Les C1G, C2G et C3G orales, le cotrimoxazole, les fluoroquinolones et les tétracyclines ne sont pas
Pneumonies sans signes de gravité : avant l’âge de 3 ans
Le pneumocoque est l’agent bactérien en cause le plus fréquent avant l’âge de 3 ans.
L’antibiothérapie recommandée en première intention est l’amoxicilline 80–100 mg/kg par jour per os (sans dépasser 3 g par jour) en trois prises, pendant 5 jours.
En cas d’allergie aux pénicillines sans contre-indication aux céphalosporines, il peut être prescrit une C3G injectable (céfotaxime, ceftriaxone).
En cas de contre-indication à l’ensemble des bêtalactamines (situation exceptionnelle), l’hospitalisation est souhaitable pour instituer une antibiothérapie adaptée par voie injectable.
En cas de souche supposée de PSDP (antécédents de pneumonie avant l’âge de 1 an, traitements antérieurs par bêtalactamines, hospitalisation récente il y a moins de 3 mois), il est inutile de prescrire des posologies plus élevées d’amoxicilline.
Dans de rares cas, seules l’absence de vaccination ou une vaccination incomplète contre Haemophilus influenzae de type b peuvent conduire à proposer l’association amoxicilline + acide clavulanique dosée à 80 mg/kg par jour d’amoxicilline.
Pneumonies sans signes de gravité : après l’âge de 3 ans
Le pneumocoque et le mycoplasme sont les principaux agents bactériens en cause à partir de l’âge de 3 ans.
Le choix antibiotique initial probabiliste s’appuie sur l’analyse du tableau clinique et radiographique, bien que ceux-ci n’aient pas de valeur prédictive étiologique.
Chez un enfant sans terrain à risque, une bithérapie n’est pas indiquée d’emblée.
En cas de tableau évocateur d’une infection à pneumocoque, l’antibiothérapie recommandée est l’amoxicilline 80–100 mg/kg par jour per os (sans dépasser 3 g par jour) en trois prises, pendant 5 jours.
En cas de contre-indication à l’ensemble des bêtalactamines, la pristinamycine peut être utilisée après l’âge de 6 ans (sinon l’hospitalisation est souhaitable).
En cas de tableau évocateur d’une infection à mycoplasme, l’antibiothérapie recommandée est un macrolide.
Lorsque le tableau n’est pas franc, il faut toujours privilégier l’amoxicilline, le pneumocoque restant le germe le plus redouté.
Pneumonies avec signes de gravité
Le pneumocoque est toujours pris en compte en premier lieu.
En cas de vomissements ou d’altération de l’état général, la voie IV est nécessaire.
En cas de pneumonie aiguë chez un enfant drépanocytaire, il peut être prescrit une bithérapie : amoxicilline et macrolide. La bêtalactamine peut être modifiée pour une C3G injectable dans les formes sévères.
En cas de pleurésie purulente, une antibiothérapie intraveineuse forte dose est débutée, couvrant pneumocoque, staphylocoque doré et streptocoque A.
Pneumonie avant l’âge de 3 ans : amoxicilline.
Pneumonie après l’âge de 3 ans : amoxicilline voire macrolide.
Pneumonie avec signes de gravité : élargissement possible aux associations couvrant pneumocoque, staphylocoque doré et streptocoque du groupe A.
2. Traitements symptomatiques
En cas de détresse respiratoire (selon sa sévérité) :
- libération des voies aériennes supérieures ;
- mise en position proclive ou demi-assise ;
- oxygénation adaptée à la SpO2.
Drainage pleural en cas d’épanchement : en aucun cas systématique ; discussion spécialisée nécessaire.
Kinésithérapie respiratoire : pas d’indication habituelle.
Traitement de la fièvre et de la douleur : paracétamol 15 mg/kg/6 heures.
AINS non recommandés, car favorisant la survenue d’épanchement pleural.
C. Suivi
1. Critères de surveillance
Surveillance de l’enfant hospitalisé :
- scope cardiorespiratoire, température, FR, SpO2, FC, conscience ;
- signes de lutte respiratoire, auscultation pulmonaire ;
- poids, hydratation, aptitude à la prise alimentaire.
Consignes de surveillance en cas de prise en charge ambulatoire :
- évolution symptomatique ;
- température, état général, prise alimentaire.
Une prise en charge ambulatoire doit être « encadrée ».
Les conseils de surveillance doivent être notés sur l’ordonnance et/ou dans le carnet de santé (signes de détresse respiratoire, difficultés à la prise alimentaire, fièvre mal tolérée).
Une réévaluation médicale à 48–72 heures de prise en charge est recommandée, et ce quelle que soit l’évolution.
2. Évolution habituelle d’une pneumonie
La normalisation thermique est le principal critère d’efficacité thérapeutique.
L’apyrexie est obtenue en 24–48 heures sous amoxicilline pour une pneumonie à pneumocoque (critère diagnostique indirect), en 3 à 5 jours pour une pneumonie virale, parfois plus pour une pneumonie à mycoplasme.
La toux se réduit habituellement en quelques jours ; elle peut persister plus durablement en cas de pneumonie à mycoplasme (par hyperréactivité bronchique). La fréquence respiratoire et les signes de lutte se réduisent de façon parallèle.
L’évolution est beaucoup plus longue en cas d’épanchement pleural associé.
La fièvre peut ici être présente pendant 7 à 10 jours. Sa persistance inhabituelle ou sa réascension importante doivent faire évoquer soit une infection bactérienne non contrôlée avec épanchement enkysté, soit un syndrome inflammatoire durable (éventualité plus fréquente).
Les radiographies pulmonaires ne doivent pas être multipliées en cas de normalisation des signes cliniques et de stabilité des images radiologiques initiales. La normalisation complète n’est pas observée avant plusieurs semaines.
3. Échec de l’antibiothérapie initiale
La permanence de la fièvre ou sa réascension à 48–72 heures laisse craindre :
- une inadaptation de l’antibiothérapie initiale à l’agent microbien en cause ;
- une mauvaise compliance thérapeutique, une erreur de posologie, ou une non-prise (par exemple en raison de vomissements) ;
- une complication à type de pleuropneumopathie infectieuse ou d’abcès ;
- un diagnostic différentiel.
Cette situation d’échec impose la prescription de nouveaux examens (fig. 59.7) :
- un cliché thoracique ;
- une hémoculture et un bilan inflammatoire (NFS, CRP ± PCT).
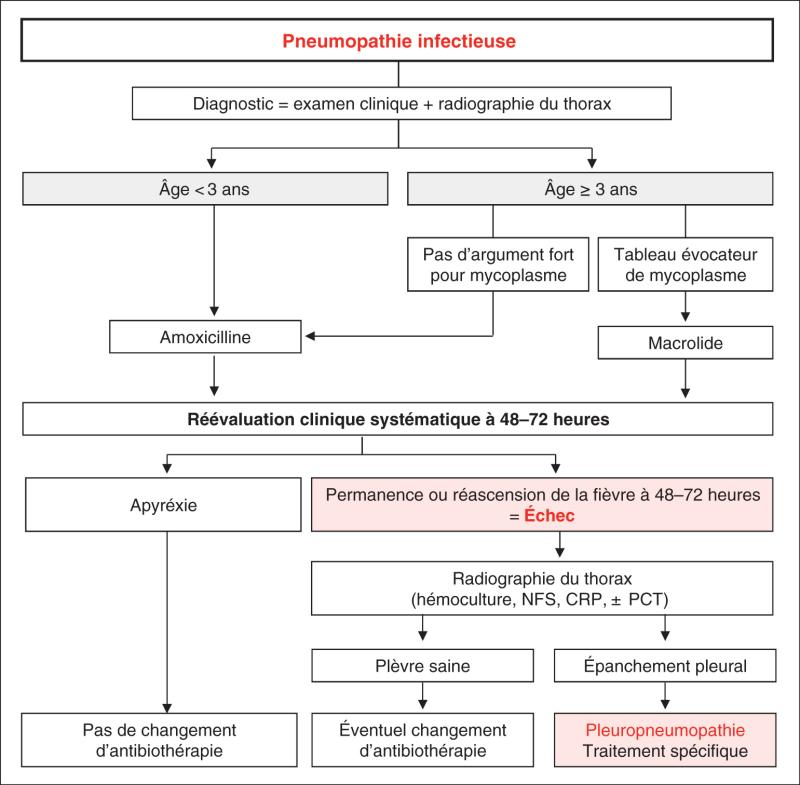
Fig. 59.7. ![]() Synthèse de la prise en charge d’une pneumonie aiguë.
Synthèse de la prise en charge d’une pneumonie aiguë.
La radiographie de thorax recherche avant tout une complication pleurale :
- si le cliché thoracique est inchangé :
- éventualité d’une bactérie atypique (mycoplasme) ;
- possible remplacement de l’amoxicilline par un macrolide en monothérapie ;
- si le cliché thoracique montre un épanchement pleural :
- hospitalisation pour poursuite des explorations ;
- antibiothérapie IV selon les modalités détaillées.
Si un diagnostic différentiel est suspecté, un scanner thoracique peut être indiqué.
Craindre une pleurésie purulente en cas d’échec à 48–72 heures du début de l’antibiothérapie.
4. Suivi à long terme et pronostic
La pneumonie à pneumocoque n’induit pas généralement de séquelles à long terme.
La pneumonie à Mycoplasma pneumoniae peut parfois être responsable d’une hyperréactivité bronchique résiduelle avec toux prolongée et, rarement, de dilatations des bronches.
La normalisation du cliché thoracique est habituelle en 1 mois.
Un premier épisode de pneumonie d’allure pneumococcique facilement résolutif, chez un enfant sans facteur de risque, ne justifie pas de contrôle radiographique à 1 mois (Afssaps).
En pratique, un cliché est régulièrement effectué afin de s’assurer qu’un nouvel épisode ultérieur de pneumonie soit bien considéré comme une authentique récidive.
5. Prise en charge des récidives
Principales causes à évoquer :
- un équivalent d’asthme (très fréquent, signes évocateurs d’hyperréactivité bronchique, normalisation radiologique entre deux épisodes, atteinte fréquente du lobe moyen) ;
- une pathologie sous-jacente pulmonaire :
- malformation pulmonaire congénitale (même localisation des récidives, absence de normalisation radiologique entre deux épisodes, images kystiques) ;
- dilatation des bronches, pathologie mucociliaire, mucoviscidose ;
- une cause obstructive :
- corps étranger inhalé (même localisation des récidives) ;
- compression extrinsèque des voies aériennes, notamment par des adénopathies tuberculeuses ;
- un possible déficit immunitaire (si ≥ 2 pneumonies/an).
Ces récidives de pneumonies doivent motiver des explorations et un avis spécialisé :
- selon l’orientation clinique et radiologique : TDM thoracique ;
- endoscopie bronchique ;
- explorations fonctionnelles respiratoires ;
- enquête immunitaire (voir chapitre 26).
Pneumonies récidivantes dans un même territoire : évoquer un corps étranger intrabronchique.
Références
GPIP. Guide de prescription d’antibiotique en pédiatrie.
Actualisation 2024 en cours de publication.

|
GRAPP. Recommandations sur l’utilisation des nouveaux outils diagnostiques étiologiques des infections respiratoires basses de l’enfant de plus de 3 mois. Arch Ped 2014;21:418–23. https://www.sfpediatrie.com/sites/www.sfpediatrie.com/files/medias/docu… |
|

|
Madji F, Mazenq J. Épanchement pleural liquidien chez l’enfant. Pas à pas en pédiatrie. Arbres décisionnels commentés des Sociétés de pédiatrie. 2022. https://pap-pediatrie.fr/files/2022_03_epanchement_pleural_liquidien_ch… |
