Items, objectifs pédagogiques
Item 213 – Anémie chez l’adulte et l’enfant
- Connaître les principales hypothèses diagnostiques et les examens complémentaires pertinents.
- Apprécier la gravité d’une anémie.
- Connaître les urgences liées à l’anémie et les signes de gravité (terrain, rapidité d’installation et profondeur).
Item 212 – Hémogramme chez l’adulte et l’enfant : indications et interprétation
- Argumenter les principales indications de l’hémogramme, discuter l’interprétation des résultats et justifier la démarche diagnostique si nécessaire.
Item 219 – Pathologie du fer chez l’adulte et l’enfant
- Diagnostiquer une carence ou une surcharge en fer.
- Connaître les principes du traitement de la carence martiale chez l’adulte et l’enfant.
- Connaître les principes du traitement d’une surcharge en fer.
Item 329 – Transfusion sanguine et produits dérivés du sang : indications, complications. Hémovigilance
- Expliquer les risques transfusionnels, les règles de prévention, les principes de traçabi-lité et d’hémovigilance.
- Prescrire une transfusion des médicaments dérivés du sang.
Avant de commencer…
L’anémie est définie par un taux d’hémoglobine (Hb) en dessous de – 2 DS par rapport aux valeurs moyennes pour l’âge de l’enfant.
Elle peut être découverte soit à l’occasion d’une NFS prescrite de manière systématique, soit devant la présence de signes cliniques liés à l’anémie (notamment pâleur et asthénie).
Devant la constatation clinique ou biologique d’une anémie, il importe de :
- rechercher avant tout des signes de gravité afin de traiter d’éventuelles situations d’urgence ;
- réaliser une enquête étiologique structurée, afin d’assurer une prise en charge spécifique.
Les examens complémentaires d’orientation, au premier rang desquels la NFS, le VGM ainsi que les réticulo-cytes, permettent d’évoquer des cadres étiologiques spécifiques.
▶ Les « spécificités pédiatriques » seront détaillées. Les points clés de deux causes seront secondairement développés : la carence martiale et la drépanocytose.
I. Hémogramme chez l’enfant
A. Normes d’hémoglobine et anémie
Les normes d’hémoglobine varient selon l’âge et, à l’adolescence, selon le sexe.
L’anémie est définie par la diminution du taux d’hémoglobine (exprimée en g/dl) en dessous de – 2 DS par rapport à la moyenne pour l’âge (tableau 23.1).
Les données chiffrées du tableau 23.1 ne sont pas à mémoriser pour les ED.
Le taux d’hémoglobine varie beaucoup durant les premiers mois de la vie de manière physiologique, principalement en lien avec l’adaptation à la vie extra-utérine nécessitant un changement de la composition de l’hémoglobine. Le taux d’hémoglobine est élevé à la naissance autour de 16,5 g/dl. La norme d’hémoglobine chute ensuite de 5 points avec un nadir entre 3 et 6 mois pour atteindre un taux moyen de 11,5 g/dl et une limite inférieure à 9,5 g/dl. Le taux d’hémoglobine remonte ensuite pour se rapprocher des normes adultes.
Tableau 23.1. ![]() Anémie et normes de la NFS.
Anémie et normes de la NFS.
| Paramètre | < 3 mois | 3–6 mois | 6–24 mois | 2–6 ans | 6–12 ans | 12–18 ans | |
|---|---|---|---|---|---|---|---|
| Fille | Garçon | ||||||
| Hb moyenne (g/dl) | 16,5 | 11,5 | 12,5 | 12 | 13,5 | 14 | 14,5 |
| – 2 DS (g/dl) = anémie | 13,5 | 9,5 | 10,5 | 11,5 | 11,5 | 12 | 13 |
| VGM (fL) | 90–120 | 72–82 | 75–85 | 78–88 | 80–90 | 90 | 88 |
B. Normes des autres lignées de la NFS
Leurs normes (exprimées en Giga : 109/l) varient selon l’âge pour les leucocytes, alors que le taux pla-quettaire normal est sensiblement identique quel que soit l’âge (entre 150 et 400 G/l). Passé les 3 pre-miers mois de vie, le taux normal de réticulocytes est compris entre 40 et 80 G/l.
Connaître leur évolution au cours de la vie permet d’apprécier l’intégrité des lignées de la NFS et de ne pas méconnaître une pathologie médullaire.
Les données chiffrées du tableau 23.2 ne sont pas à mémoriser pour les ED.
La formule des leucocytes varie beaucoup au cours des pre-miers mois de vie. Le taux de lymphocytes est plus élevé que chez les adultes. La constatation d’une lym-phopénie dans les premiers mois peut être un point d’appel pour un déficit immunitaire combiné sé-vère ; un contrôle et un avis spécialisé sont alors nécessaires (voir chapitre 26).
Tableau 23.2. ![]() Valeurs de référence des leucocytes, neutrophiles et lymphocytes (109/l) chez l’enfant.
Valeurs de référence des leucocytes, neutrophiles et lymphocytes (109/l) chez l’enfant.
| Paramètre | Naissance | 1 mois | 6 mois | 2 ans | 4 ans | 10 ans |
|---|---|---|---|---|---|---|
| Leucocytes | 18,1 | 10,8 | 11,9 | 10,6 | 9,1 | 8,1 |
| Neutrophiles | 11 | 3,8 | 3,8 | 3,5 | 3,8 | 4,4 |
| Lymphocytes | 5,5 | 6 | 7,3 | 6,3 | 4,5 | 3,1 |
D’après : Swaanenburg JC, Rutten WP, Holdrinet AC, Van Strik R. The determination of reference values for hematologic parameters using results obtained from patient populations. Am J Clin Pathol 1987;88:182–91.
Retenir les « tendances » de ces différents paramètres selon l’âge de l’enfant.
II. Diagnostiquer une anémie et planifier la prise en charge
A. Identifier une anémie
Suspicion clinique devant :
- une asthénie révélée par des difficultés à la prise alimentaire chez le nourrisson, une dyspnée d’effort, une baisse d’attention scolaire chez l’enfant plus âgé ;
- une pâleur cutanéomuqueuse (téguments, lèvres et conjonctives en particulier chez l’enfant à peau noire), un teint cireux ;
- un souffle systolique fonctionnel maximal à l’apex, une tachycardie, des malaises avec hypotension, une polypnée isolée (pas de cyanose, pas de fièvre) en cas d’anémie sévère ;
- une hypotrophie avec cassure de la courbe staturo-pondérale (en cas d’anémie chronique).
Confirmation biologique : NFS.
B. Apprécier la gravité
Terrain à risque :
- âge (en particulier jeune nourrisson), antécédents de transfusion ;
- maladie cardiorespiratoire, drépanocytose, cancer en cours de traitement (chimiothérapie), immu-nodépression ;
- pathologie de l’hémostase connue, prise de médicaments (AINS, anticoagulants).
Signes de mauvaise tolérance symptomatique de l’anémie :
- retentissement cardiovasculaire :
- tachycardie, polypnée, dyspnée au moindre effort, malaise ;
- souffle cardiaque > 2/6 ;
- collapsus en cas d’hémorragie aiguë, signes d’insuffisance cardiaque ;
- troubles de la conscience ou du comportement :
- agitation, angoisse, hypotonie ;
- diminution voire arrêt de la prise alimentaire chez le nourrisson.
Signes orientant vers une cause potentiellement grave :
- signes évoquant une cause centrale (atteinte des autres lignées médullaires) :
- syndrome hémorragique grave avec purpura (thrombopénie) ;
- fièvre, angine, stomatite (neutropénie) ;
- syndrome tumoral : adénopathies, hépatosplénomégalie, atteinte testiculaire, douleurs os-seuses ;
- signes d’hémolyse aiguë : urines rouges ou foncées, ictère conjonctival ;
- autres : hémorragie extériorisée, plaie ouverte.
Une anémie inférieure à 7 g/dl est considérée comme sévère.
L’existence d’une atteinte des autres lignées doit alerter. Une thrombopénie ou un trouble de l’hémostase associé sont des indices complémentaires de sévérité.
La décision d’une transfusion de produits sanguins repose plus sur la tolérance clinique de l’anémie que sur le chiffre de l’hémoglobine (voir § II.E. Savoir prescrire une transfusion de CGR).
C. Connaître les mesures d’urgence
Toute anémie mal tolérée cliniquement, et/ou liée à une hémorragie active importante, et/ou majeure à la NFS, constitue une urgence thérapeutique.
Aucun examen complémentaire ne doit retarder les mesures d’urgence. Il convient d’effectuer si pos-sible un minimum de prélèvements à visée étiologique en fonction du tableau clinique avant toute trans-fusion de produits sanguins (difficultés diagnostiques pour certaines causes après transfusion).
Mesures urgentes éventuelles dans les formes sévères :
- mise en condition en box de déchocage :
- monitoring cardiorespiratoire, oxygénothérapie ;
- pose d’au moins une voie veineuse périphérique de gros calibre ;
- gestes thérapeutiques immédiats selon les cas :
- compression d’une plaie, arrêt d’éventuels anticoagulants ;
- remplissage vasculaire (avant transfusion) ;
- transfusion avec urgence vitale immédiate : O Rh négatif sans hémolysine ;
- réalisation d’un premier bilan paraclinique :
- Hémocue® : utile en cas de syndrome hémorragique aigu (attention : parfois faussement ras-surant en début de saignement, même massif) ;
- groupe ABO (deux déterminations), Rhésus, RAI ;
- NFS + frottis sanguin, réticulocytes, hémostase ;
- surveillance clinique rapprochée :
- température, FR, SpO2, FC, PA ;
- évaluations hémodynamique et neurologique répétées.
Gravité : troubles hémodynamiques, atteinte des autres lignées.
En cas d’hémorragie sévère : groupe ABO (2 déterminations), Rhésus, RAI.
D. Conduire l’enquête étiologique
1. Enquête clinique minutieuse
Anamnèse
Éléments du dossier obstétrical (si nouveau-né) et antécédents familiaux :
- hémoglobinopathie, enzymopathie, anomalies de membrane du globule rouge ;
- carence martiale maternelle, multiparité, prématurité, RCIU.
Terrain :
- âge, sexe, origine ethnique, croissance staturo-pondérale (cassure) ;
- antécédents personnels de maladie chronique, œsophagite, ulcère.
Mode de vie :
- prise de médicaments (aspirine, AINS…) ou de fèves, voyage à l’étranger ;
- allaitement maternel prolongé > 6 mois, régime pauvre en produits carnés ;
- pica, ingestion de peinture au plomb.
Mode d’installation de l’anémie :
- mode de révélation, date de début des symptômes ;
- rapidité de constitution et retentissement cardiorespiratoire.
Signes fonctionnels :
- diarrhée chronique, anorexie, dégoût de la viande, épigastralgies ;
- épistaxis répétées, règles abondantes, saignement aigu.
Examen physique
Signes de sévérité symptomatique et de cause potentiellement grave :
- cause tumorale : adénopathies, hépatosplénomégalie, purpura, fièvre ;
- hémolyse aiguë : urines rouges (hémoglobinurie), signes généraux liés à l’hémolyse elle-même (fris-sons, fièvre, douleurs lombaires).
Autres signes à rechercher :
- signes de carence martiale : ongles mous, perlèche, glossite, infections ;
- signes de pathologie auto-immune ou inflammatoire.
Deux tableaux cliniques distincts orientant l’enquête étiologique d’une anémie hémolytique :
- hémolyse aiguë : urines rouges en rapport avec l’hémoglobinurie, subictère et splénomégalie peu marquée ; risque de complication aiguë (insuffisance rénale avec oligoanurie par précipitation tubu-laire d’hémoglobine, malaise, voire choc anémique) ;
- hémolyse chronique : urines foncées, ictère marqué, splénomégalie volumineuse et lithiase dans la vésicule biliaire avec risques de complications.
2. Enquête paraclinique orientée
Paramètres à considérer en priorité devant une anémie
Réticulocytes :
- réticulocytes < 50–150 G/l : anémie arégénérative (< 50 G/l) ou peu régénérative (50–150 G/l) ;
- réticulocytes ≥ 150 G/l : anémie régénérative.
Volume globulaire moyen (VGM) :
- VGM < 80 fL : anémie microcytaire ;
- VGM > 100 fL : anémie macrocytaire.
Le nouveau-né a une macrocytose physiologique, puis le VGM diminue rapidement (on définit la micro-cytose pour un VGM < 70 fL chez le nourrisson). Le VGM augmente ensuite pour rejoindre très progres-sivement les normes adultes vers l’âge de 10 ans.
Autres examens effectués selon l’orientation clinique
En cas d’anémie microcytaire :
- bilan martial : ferritine (en première intention), coefficient de saturation de la transferrine si doute avec inflammation associée ;
- bilan inflammatoire : VS, CRP ;
- électrophorèse de l’hémoglobine, dosage du plomb (en deuxième intention).
En cas d’anémie normo- ou macrocytaire :
- arégénérative : discuter myélogramme, enquête infectieuse (PCR parvovirus B19) ;
- régénérative : bilan d’hémolyse = bilirubine libre (élevée), LDH (élevé), haptoglobine (effondrée).
En cas d’hémolyse aiguë :
- frottis sanguin : anomalies morphologiques du globule rouge (par exemple : recherche de schizo-cytes en faveur d’un syndrome hémolytique et urémique), recherche de parasites (paludisme) en cas de voyage en pays d’endémie ;
- test de Coombs : anémie hémolytique auto-immune (AHAI) ;
- dosage de la G6PD et pyruvate kinase ;
- créatininémie, protéinurie.
En cas d’hémolyse chronique :
- test de Coombs : AHAI ;
- étude des différents compartiments du globule rouge en rapport avec une cause corpusculaire d’hémolyse : membrane, enzymes (G6PD, pyruvate kinase), électrophorèse de l’hémoglobine.
Plusieurs causes d’anémie peuvent être intriquées ; ce qui peut rendre parfois l’interprétation des pa-ramètres biologiques difficile (par exemple, hémolyse constitutionnelle et carence martiale).
Une AHAI isolée ou s’intégrant dans le cadre d’un syndrome d’Evans (association simultanée ou séquen-tielle d’une AHAI et d’un purpura thrombocytopénique) peut révéler ou s’associer à un déficit immuni-taire chez l’enfant (voir chapitre 26).
Orientation clinique : urines rouges ou foncées, ictère, syndrome tumoral, purpura.
Orientation biologique : VGM et réticulocytes.
3. Principales causes d’anémie chez l’enfant
- Causes centrales (arégénératives) :
- insuffisance médullaire d’origine carentielle (défaut de production) ;
- envahissement ou aplasie médullaire ;
- cause infectieuses (parvovirus B19, leishmaniose viscérale).
- Causes périphériques (régénératives) :
- hémolyse (excès de destruction) ;
- hémorragie (perte excessive).
L’arbre diagnostique proposé figure 23.1 permet de schématiser la conduite diagnostique et de synthéti-ser les causes d’anémie en pédiatrie.
L’ensemble des causes d’anémie ne sont pas détaillées dans ce chapitre.
Certaines anémies hémolytiques du nouveau-né sont explicitées dans le chapitre 45.
Les points clés de la carence martiale et de la drépanocytose seront traités ci-dessous.
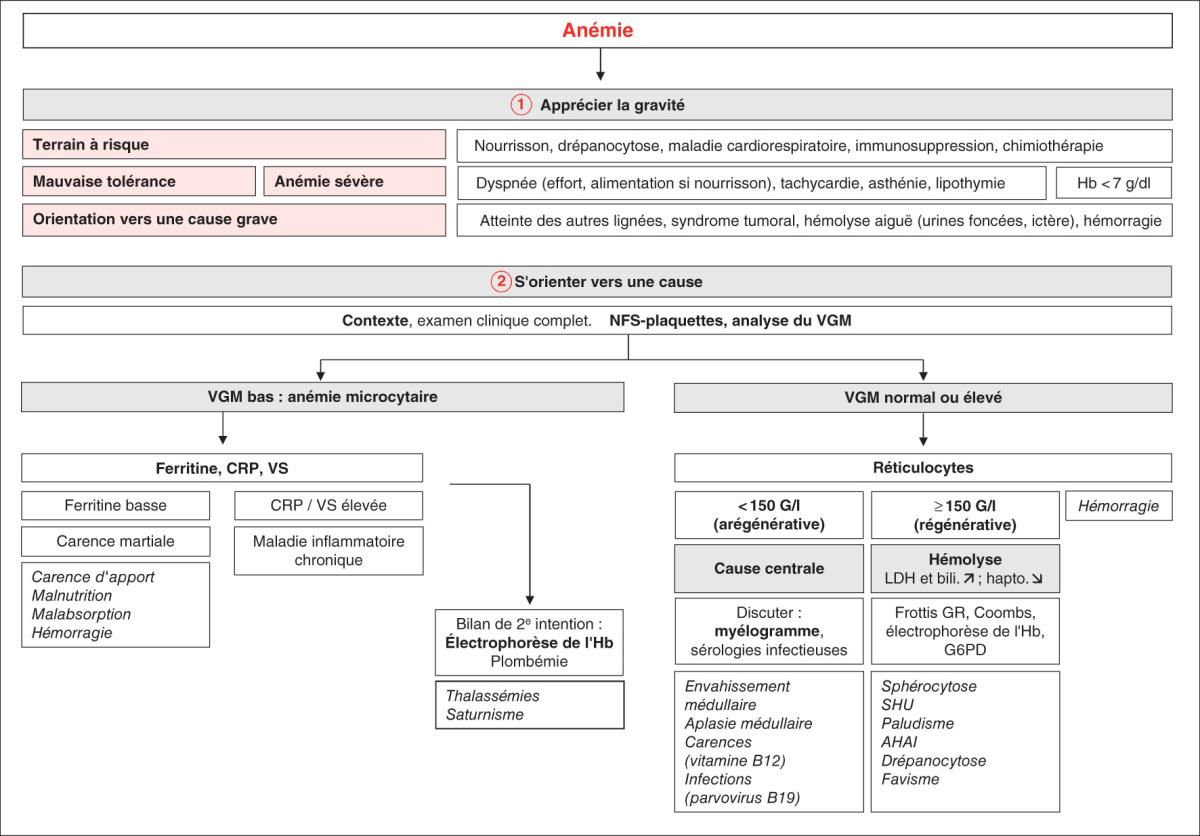
Fig. 23.1. ![]() Conduite diagnostique en cas d’anémie chez l’enfant.
Conduite diagnostique en cas d’anémie chez l’enfant.
E. Savoir prescrire une transfusion de CGR
La décision de transfuser un enfant doit prendre en compte :
- la tolérance clinique ;
- la profondeur de l’anémie ;
- le risque d’aggravation (hémorragie ou hémolyse actives) et le potentiel de récupération rapide (réti-culocytose).
Les grands principes de transfusion de CGR sont proches de ceux appliqués chez l’adulte. Seuls les mes-sages essentiels pour la pratique clinique sont rappelés ici.
Avant la transfusion :
- connaître les antécédents de transfusion de l’enfant (nombre, accidents éventuels) ;
- information des parents ± de l’enfant sur le rapport bénéfices/risques, accord parental ;
- bilan prétransfusionnel (± prélèvements à visée étiologique non interprétables ensuite).
Commande des culots globulaires :
- nom, prénom, âge, poids de l’enfant, chiffre d’hémoglobine, tolérance clinique ;
- date, identification du prescripteur, signature, degré d’urgence ;
- quantité à transfuser = Hb × 3–4 × poids en kg (sans dépasser 20 ml/kg) ;
- systématiquement : isogroupe et iso-Rhésus, déleucocytés ;
- particularités : phénotypés si transfusions itératives, compatibilisés si RAI+ ou drépanocytose, irradiés si cancer en cours de traitement, greffé ou autre déficit immunitaire.
Modalités de la transfusion :
- contrôle ultime au lit : concordance de l’identité, méthode ABTest Card® ;
- vitesse de transfusion : 6–10 ml/kg/h ;
- surveillance rapprochée des paramètres vitaux (température, hémodynamique, conscience).
Après la transfusion :
- traçabilité : notification dans les dossiers transfusionnel, médical et le carnet de santé ;
- vérification de l’efficacité de la transfusion : examen clinique, NFS de contrôle à discuter ;
- bilan post-transfusionnel : RAI à 3 mois (sérologies virales non recommandées).
Transfusion : CGR isogroupes déleucocytés, surveillance clinique, traçabilité.
III. Points clés à propos de deux causes d’anémie
A. Carence martiale
1. Généralités
La carence martiale est la première cause d’anémie en pédiatrie et la plus fréquente des carences nutritionnelles dans le monde.
Elle est responsable d’une anémie microcytaire (VGM < 80 fL), hypochrome (TCMH < 32 %), arégénéra-tive, ± associée à une thrombocytose modérée.
Les carences martiales sont dues :
- le plus souvent : à une carence d’apport et/ou une majoration des besoins ;
- parfois : à un défaut d’absorption ;
- rarement : à un excès de pertes, en particulier des saignements chroniques digestifs.
Les besoins en fer sont importants à couvrir chez le nourrisson, en raison du rôle essentiel du fer dans la synthèse de l’hémoglobine et dans le développement et le fonctionnement du système nerveux central.
Le fer héminique (viande, poisson, abats) est 5 à 10 fois mieux absorbé que le fer non héminique (lait, végétaux, œuf). La teneur en fer du lait de vache est très faible, ce qui le rend inadapté à l’alimentation du nourrisson.
2. Diagnostic
Identifier une carence martiale
Le diagnostic (biologique) d’anémie par carence martiale repose sur :
- une microcytose ;
- une ferritinémie effondrée.
La HAS recommande en première intention le dosage sérique de la ferritine.
Les paramètres biologiques sont concernés selon la cinétique suivante : baisse de la ferritine, baisse du coefficient de saturation de la transferrine, élévation de la transferrinémie, baisse du fer sérique, micro-cytose, hypochromie, baisse du taux d’hémoglobine.
Si la ferritinémie est normale, il peut s’agir d’une anémie inflammatoire ou d’une anémie mixte (inflam-matoire et carentielle). Le syndrome inflammatoire peut en effet augmenter le taux de ferritine et le normaliser, alors qu’il existe pourtant une carence martiale associée. Le coefficient de saturation de la transferrine peut alors davantage orienter.
Faire le diagnostic étiologique
Lune carence nutritionnelle : durée de l’allaitement, consommation insuffisante de préparations infan-tiles ou de produits carnés, végétarisme/végétalisme ;
- des infections anormalement fréquentes (notamment des voies respiratoires) ;
- des troubles neuropsychiatriques (TDAH, dépression, difficultés scolaires) ;
- des troubles du comportement alimentaire (pica) ;
- des signes d’atrophie muqueuse et de fragilité des phanères (rares) ;
- des règles abondantes chez l’adolescente.
Le tableau 23.3 synthétise les causes possibles de carence martiale.
Tableau 23.3. ![]() Causes de carence martiale chez l’enfant.
Causes de carence martiale chez l’enfant.
| Insuffisance d’apport (principale cause de carence martiale) |
|
| Réserves en fer insuffisantes |
|
| Défaut d’absorption |
|
| Saignements répétés |
|
3. Planification de la prise en charge et suivi de l’enfant
Traitement curatif
Le traitement étiologique est essentiel et propre à la cause retrouvée.
Une correction des erreurs diététiques peut suffire dans certains cas : augmentation de la consommation de préparations infantiles, remplacement du lait de vache par du lait de croissance, consommation de deux produits carnés par jour.
La supplémentation en fer est indispensable dès le diagnostic dans les autres situations.
La prescription de fer se fait sous la forme de fer ferreux. Les molécules disponibles sont : fumarate de fer et ferédétate de sodium. Les parents et l’enfant doivent être informés des effets secondaires potentiels : coloration noire des selles, troubles digestifs.
La supplémentation martiale dure de 3 à 6 mois, selon le taux d’Hb et la cause.
La réponse au traitement est rapide, avec la survenue d’une crise réticulocytaire vers J10.
La correction progressive des paramètres biologiques se fait selon une cinétique inversée par rapport à celle décrite précédemment : l’anémie se corrige généralement en 1 mois, mais c’est la normalisation différée de la ferritine qui permet de mettre un terme au traitement
Traitement préventif
La prévention de la carence martiale repose sur :
- la supplémentation en fer systématique des prématurés et des nourrissons exclusivement ou majoritairement allaités après l’âge de 6 mois ;
- la consommation d’au moins trois biberons quotidiens de préparation de suite (700 ml par jour) jusqu’à l’âge de 1 an ;
- la consommation de lait de croissance jusqu’à au moins l’âge de 3 ans, mais il est souvent nécessaire de la prolonger jusqu’à 6 ans en cas d’apports carnés insuffisants ;
- la consommation de deux produits carnés par jour dès l’arrêt du lait de croissance.
Cause de carence martiale fréquente : erreur nutritionnelle.
Anémie par carence martiale : VGM < 80 fL, ferritine effondrée.
Prise en charge : traitement étiologique, correction des erreurs diététiques, supplémentation martiale.
B. Drépanocytose
1. Généralités
Définition
La drépanocytose est une maladie génétique autosomique récessive.
Elle concerne surtout les sujets d’origine africaine et antillaise.
Le syndrome drépanocytaire majeur regroupe trois types de manifestations :
- anémie hémolytique chronique ;
- phénomènes vaso-occlusifs (avec comme complications : crises douloureuses des membres ou de l’abdomen, syndrome thoracique aigu, accident vasculaire cérébral, priapsime, aggravation aiguë de l’anémie) ;
- susceptibilité aux infections (en particulier à germes encapsulés).
2. Diagnostic
Le diagnostic est en général fait chez un enfant à risque sur le dépistage néonatal de J3.
Les arguments biologiques classiquement retrouvés sont :
- hémogramme : anémie normo-/macrocytaire régénérative de type hémolytique ;
- frottis sanguin : drépanocytes (globules rouges falciformes) ;
- électrophorèse de l’hémoglobine : bande d’HbS, absence de bande d’HbA.
3. Planification de la prise en charge et suivi de l’enfant
Orientation en cas d’urgence
Hospitalisation en cas de :
- signes cliniques évoquant une complication aiguë sévère ;
- fièvre avant l’âge de 3 ans ou si mal tolérée à tout âge ;
- crise hyperalgique.
Principes thérapeutiques des complications
L’enfant drépanocytaire doit toujours être considéré comme un patient prioritaire.
Mesures générales :
- évaluation et traitement de la douleur ;
- hyperhydratation, oxygénothérapie si nécessaire ;
- surveillance clinique rapprochée.
Situations particulières :
- suspicion d’infection : antibiothérapie probabiliste ;
- prise en charge transfusionnelle : CGR, phénotypés, compatibilisés.
Principes thérapeutiques au long cours
Prévention des infections potentiellement graves :
- vaccination ciblée (en plus du calendrier vaccinal habituel) :
- pneumococcique (Pneumo 23®), méningococcique ACYW135 et B ;
- antigrippale annuelle ;
- antibioprophylaxie antipneumococcique : pénicilline V (Oracilline®) en prise quotidienne.
Prévention des risques de majoration de l’anémie : supplémentation en acide folique.
Drépanocytose : anémie hémolytique chronique, phénomènes vaso-occlusifs, infections.
Urgence si : fièvre, douleurs intenses, détresse respiratoire, signes neurologiques.
Prise en charge au long cours : antibioprophylaxie, vaccins spécifiques, suivi régulier.
IV. Surcharge en fer chez l’enfant
Les surcharges martiales sont essentiellement décrites chez l’enfant polytransfusé.
L’hémochromatose héréditaire se révèle essentiellement à l’âge adulte et il n’y a habituellement pas d’indication de dépistage systématique des enfants avant l’âge de 18 ans.
Les complications en rapport avec une hémochromatose sont comparables à celles de l’adulte en parti-culier sur le plan hépatique et cardiaque. Sur le plan endocrinien, des anomalies du métabolisme gluci-dique, un retard pubertaire ainsi qu’une hypoparathyroïdie peuvent être retrouvés.
Les principes de traitement rejoignent ceux de l’adulte en fonction des étiologies : chélation du fer chez l’enfant polytransfusé, saignée en cas d’hémochromatose héréditaire.
Références
- Direction générale de la Santé (DGS). Circulaire n° DGS/DHOS/SD3/2006/11 du 11 janvier 2006, relative aux analyses et tests pratiqués sur les receveurs de produits sanguins labiles.
- Tounian P (coord.). La carence martiale en pédiatrie : recommandations de la SFP. Arch Ped 2017;24(HS 5).

|
HAS. Transfusion de globules rouges homologues : produits, indications, alternatives. 2014. http://www.has-sante.fr/portail/upload/docs/application/pdf/2015-02/tra… |

|
HAS. Choix des examens du métabolisme du fer en cas de suspicion de carence en fer. 2011. http://www.has-sante.fr/portail/upload/docs/application/pdf/2011-11/tex… carence_2011-11-09_17-22-2_135.pdf |

|
HAS. Syndromes drépanocytaires majeurs de l’enfant et de l’adolescent, guide ALD 10. 2010. http://www.has-sante.fr/portail/jcms/c_938890/ald-n-10-syndromes-drepan… |
